

(图片来源:J. Am. Chem. Soc.)
正文
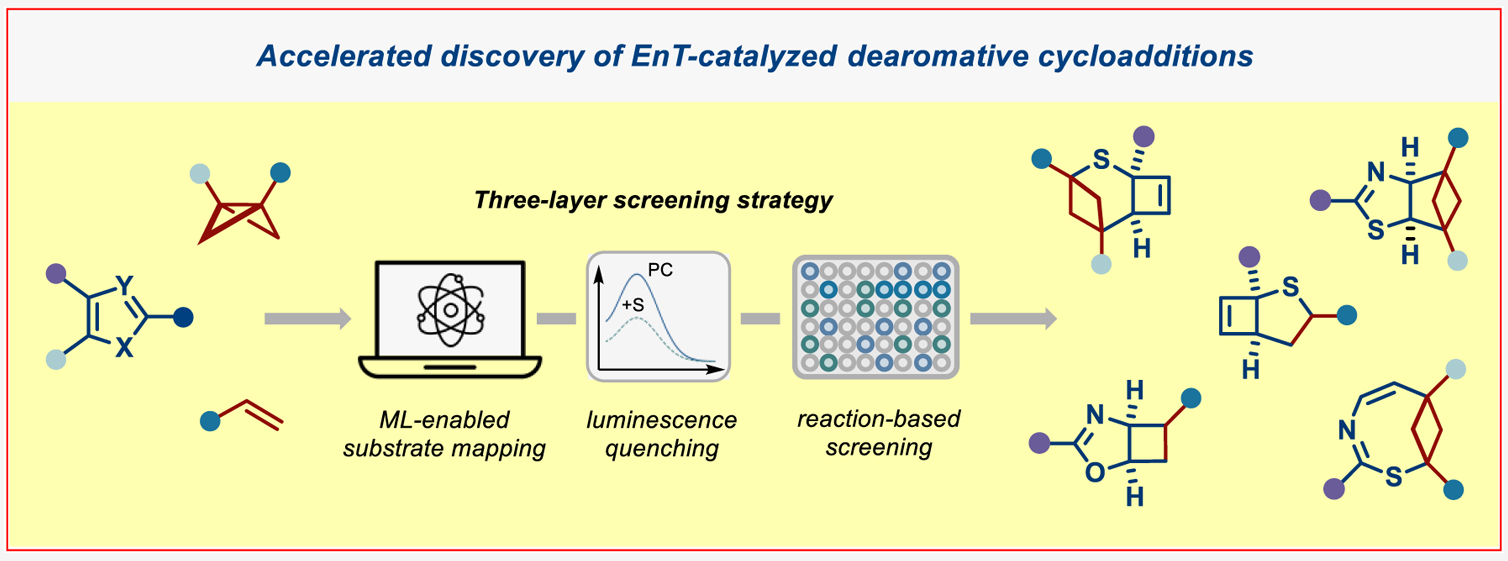
可见光介导的能量转移(EnT)光催化已成为将平面(杂)芳烃转化为复杂三维药用分子的重要策略。然而,现有的分子间去芳构化光环加成反应仅适用于双环(杂)芳烃体系,而储量更丰富的单环(杂)芳烃却鲜有研究,这主要源于其高三线态能垒所致。近日,德国明斯特大学Frank Glorius课题组报道了几种由EnT催化单环杂芳烃与烯烃以及双环[1.1.0]丁烷之间的分子间去芳构化环加成反应。为了克服三线态反应活性的固有限制并加速反应的发现过程,作者引入了一种基于数据驱动的三层筛选策略,该策略结合数据科学工具来描绘激发态性质与发光淬灭以及反应筛选。这种协同的三层筛选策略揭示了取代单环杂芳烃与双自由基受体之间的结构-活性关系,有助于加速新反应性的发现。利用这种基于数据的方法,作者开发了EnT催化噻吩、噁唑和噻唑与烯烃/双环[1.1.0]丁烷之间的分子间去芳构化环加成反应,从而得到了一系列前所未有的富含C(sp3)的三维分子骨架(Figure 1)。欢迎下载化学加APP到手机桌面,合成化学产业资源聚合服务平台。

(图片来源:J. Am. Chem. Soc.)
作者以五元杂芳烃(噻吩、呋喃、吡咯及1,3-氮唑类,ET > 70 kcal·mol-1)为研究起点。鉴于取代基模式与官能团特性对激发态行为的显著影响,作者通过构建含单/双/三取代的虚拟杂环化合物库,采用机器学习工具EnTdecker系统预测了各取代杂芳烃的三线态能量与自旋布居,并得到以下结果:(1)噻吩、呋喃和吡咯的C2位取代比C3位更能有效降低三线态能量(Figure 2A);(2)1,3-氮唑中C2位取代效果优于C5位,而C4位无显著作用;(3)羰基、芳基和卤素为最优取代基。
基于预测结果,作者选用Ir(dF(CF3)ppy)2(dtbbpy)进行发光淬灭实验,验证低三线态能底物与光催化剂的相互作用(Figure 2B)。如预期所示,预测三线态能< 60 kcal·mol-1的底物大多能显著淬灭催化剂荧光,这为后续反应筛选明确了候选底物。
在可见光照射下,作者选取杂芳烃(H1/H2/H4/H8/H10)与双自由基受体(B2/B9/B10)进行反应筛选。令人振奋的是,五类杂芳烃与B2/B9成功生成环加成产物(Figure 2E)。作者进一步通过96孔板高通量筛选(12种杂芳烃×8种受体,Figure 2F),发现噻吩、呋喃、噁唑和噻唑体系具有独特反应性,而预测结果良好的吡咯/咪唑类却无产物生成。作者后续研究将聚焦两大方向:(1)噻吩的级联去芳构化环加成/重排反应;(2)氮唑类的去芳构化环加成。

(图片来源:J. Am. Chem. Soc.)
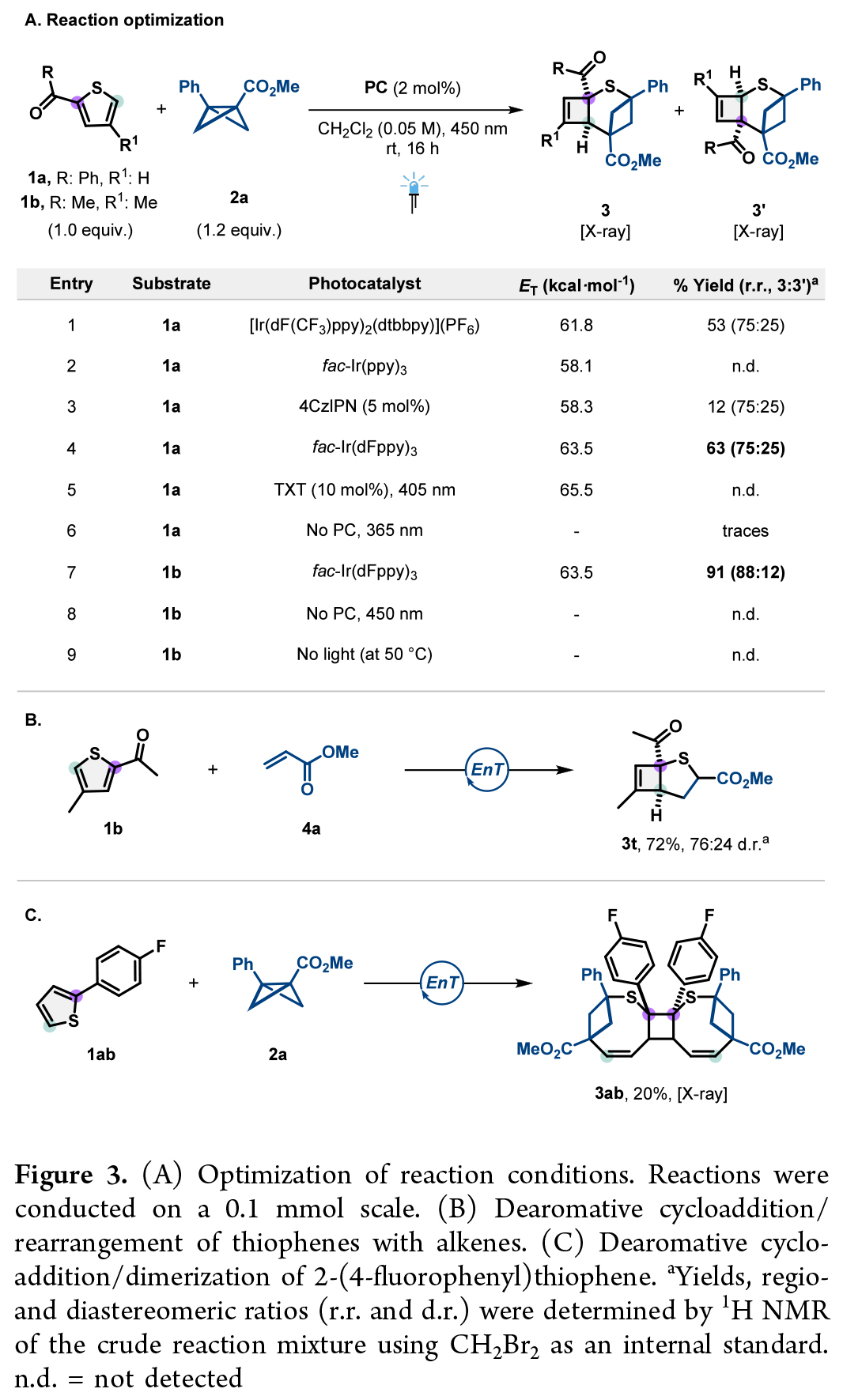
首先,作者使用苯甲酰基噻吩1a和BCB2a作为模板底物对此转化进行了探索(Figure 3A)。反应可以以53%的收率生成产物3a和3a’,区域异构体比例为75:25。主产物3a源于BCB插入空间位阻较小的C5-S键,而次要异构体3a’则通过C2-S键插入形成。通过对不同光催化剂的考察,作者发现fac-Ir(dFppy)3效果最佳。值得注意的是,当在噻吩4-位引入甲基(1b)以增加空间位阻时,不仅反应收率提升至91%,区域选择性也显著改善(88:12)(entry 7)。作者通过研究噻吩与烯烃的反应发现,噻吩1b与丙烯酸酯4a反应以72%的产率生成2-硫杂双环[3.2.0]庚-6-烯骨架3t(Figure 3B)。出人意料的是,2-(4-氟苯基)噻吩1ab与2a反应生成了二聚环加成产物3ab,而非预期的三环产物(Figure 3C)。
(图片来源:J. Am. Chem. Soc.)
为了深入探究反应机制并验证能量转移催化模式,作者开展了一系列机理实验(Figure 4)。紫外-可见吸收光谱表明在450 nm波长处仅有fac-Ir(dFppy)3存在特征吸收(Figure 4A);Stern-Volmer淬灭实验证实1a是fac-Ir(dFppy)3激发态的主要淬灭剂(Figure 4B);反应量子产率测定值Φ = 0.13排除了自由基链式反应途径;循环伏安(CV)测试表明激发态fac-Ir(dFppy)3难以氧化/还原1a或1b,从而排除了光氧化还原路径的可能性(Figure 4C)。
基于上述结果,作者提出如下机制(Figure 4D):可见光激发产生的*fac-Ir(dFppy)3通过三线态-三线态能量转移生成1a*,其自旋密度分析显示C5位自旋布居最高,C2位次之。由于C5位空间位阻较小,1a*优先从此位点与2a加成形成三线态双自由基中间体I。随后噻吩环C4位自由基诱导环裂解产生中间体II,经系间窜越和自由基重组形成二烯中间体III。在光化学条件下,III发生对旋4π-电环化反应最终生成产物3a。该二烯中间体的存在可通过4-氟苯基噻吩1ab反应中二聚产物3ab的生成得到佐证(Figure 3C)

(图片来源:J. Am. Chem. Soc.)
在得到了最优反应条件后,作者对此转化的底物范围进行了考察(Figure5)。实验结果表明,一系列不同取代的噻吩均可顺利兼容此转化,以39-87%的产率得到相应的产物3a-3s。此外,除了BCB外,烯烃也可以作为偶联配偶体实现转化,以45-84%的产率得到相应的产物3t-3w。值得注意的是,复杂生物活性分子flurbiprofen和gemfibrozil等均可兼容,证明了此转化的实用性。

(图片来源:J. Am. Chem. Soc.)
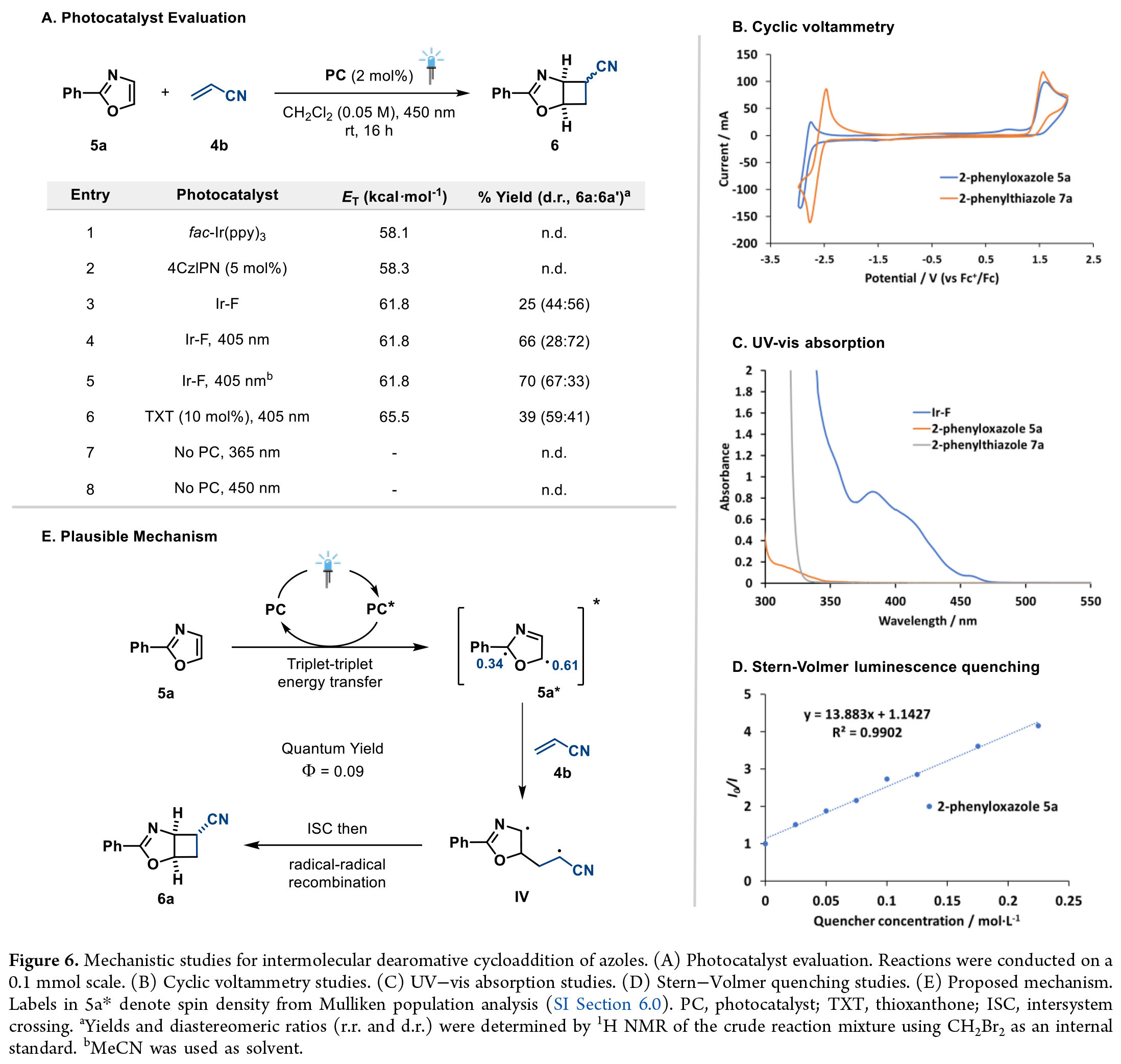
部分饱和的氮杂环化合物广泛存在于多种生物活性分子及药效团中。而利用氮杂环的去芳构化环环加成反应为一步构建这类结构提供了直接途径。基于前期研究结果,作者得出2-苯基噁唑(5a)和2-苯基噻唑(7a)能与丙烯酸酯及双环[1.1.0]丁烷形成潜在的环加成产物。通过进一步的反应条件优化作者得出最优条件为:乙腈溶剂中,405 nm光照下使用Ir-F催化剂,以70%收率(非对映选择性67:33)获得环加成产物6(Figure 6A, entry 5)。
为了验证能量转移催化机制,作者开展了一系列机理实验:循环伏安测试表明5a的氧化半峰电位为1.90 V,还原电位为-2.36 V(Figure6B)。而所用光催化剂Ir(dF(CF3)ppy)2(dtbbpy)的氧化还原电位表明,无论是氧化还是还原过程在热力学上均难以实现,从而排除了光氧化还原路径的可能性。紫外-可见吸收光谱显示,在405 nm波长处Ir-F是主要吸光物种,而5a在350 nm以上基本无吸收(Figure 6C)。值得注意的是,直接激发实验未检测到产物生成,进一步证实了可见光介导的三线态反应活性的独特性。坐着通过Stern-Volmer淬灭实验证实, 5a能高效淬灭光催化剂激发态(Figure 6D),而文献报道丙烯腈(4b)的淬灭效率较低。该反应的量子产率为0.09,排除了自由基链式反应机制的可能性。基于这些发现,作者提出如下反应机理(Figure 6E):在光激发条件下,Ir-F与5a发生三线态-三线态能量转移,生成三线态激发物种5a。自旋密度分析显示,其自旋布居主要集中于C5位,促使5a的C5中心自由基与4b发生区域选择性加成,形成中间体IV。该中间体经历系间窜越后,通过自由基-自由基重组生成环加成产物6a,其中空间位阻较小的exo-非对映异构体为主要产物。
(图片来源:J. Am. Chem. Soc.)
接下来,作者研究了噁唑环加成反应的适用范围(Figure 7)。实验结果表明将丙烯腈替换为缺电子烯烃、苯乙烯型烯烃、未活化烯烃以及含杂原子的烯烃时均可实现转化。此外,多种取代的噁唑均能良好兼容。整体以35-71%的产率得到相应的产物6a-6t。
对于噻唑,2-苯基噻唑(7a)与2a反应得到了[2π+2σ]环加成产物(8a,41%)和去芳构化插入产物(8a’,17%),且两者易于分离。此外,当苯环上含有甲氧基(8b)或溴(8c)取代基以及苯甲酰基取代的噻唑(8d)也均成功进行了环加成反应。

总结
Frank Glorius课题组报道了一种由EnT催化的单环杂芳烃与烯烃和BCBs的分子间脱芳香环加成反应。其利用三层筛选策略,整合了激发态性质的数据驱动预测、发光淬灭研究和反应筛选。这一策略使得在不同取代的单环杂芳烃中系统地探索结构-活性关系成为可能,并促进了反应性杂芳烃-双自由基受体组合的识别,从而加速了新型去芳构化转化的发现。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn