

(图片来源:Science)
正文
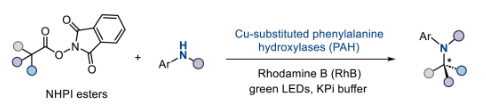
C(sp3)-N键广泛存在于生物活性分子、药物和功能材料中,因此C(sp3)-N键的构建是有机合成中不可或缺的合成过程。在过去十年中,铜催化自由基C(sp3)-N偶联成为该领域的主导合成策略。与此同时,生物催化C(sp3)-N键构建技术在过去20年快速发展,通过对转氨酶、亚胺还原酶等的改造,以及将非天然反应机制引入酶体系,实现了诸如立体选择性C(sp3)-H键胺化、烯烃氢胺化等挑战性反应。将铜催化自由基偶联与生物催化相结合,可兼具酶的选择性与铜催化的反应性,为传统方法难以实现的催化胺化反应提供新思路。其中,脱羧胺化因其能将丰富羧酸转化为胺类而极具价值。尽管铜催化体系已取得一定的进展,但实现对映收敛的脱羧C(sp3)-N偶联仍存在很大挑战。最近,美国约翰霍普金斯大学Xiongyi Huang,浙江工业大学杨云芳以及美国犹他州立大学Yi Rao课题组合作开发了光生物催化新方法,利用铜取代的非血红素酶的手性环境以及定向进化技术,高对映选择性的实现了苄位C(sp3)-N自由基偶联(Fig. 1)。欢迎下载化学加APP到手机桌面,合成化学产业资源聚合服务平台。

(图片来源:Science)
基于上述理论基础,作者首先构建了非血红素酶库进行初筛。通过模拟评估多种非血红素酶活性位点对苯胺和模型底物NHPI酯1a的容纳潜力,从中筛选出8种具有适宜活性位点环境的酶。以NHPI酯1a为底物、苯胺2b为胺偶联配偶体、罗丹明B为光催化剂,在过量Cu(II)存在下进行脱羧胺化测试。结果显示,仅苯丙氨酸羟化酶(CvPAH)表现出初始活性,能以1.1%产率和10%对映体过量(ee)生成目标产物。进一步评估发现,N-甲基苯胺2a的活性优于苯胺2b(产率1.5%,ee值16%),而烷基胺、酰胺及磺酰胺类均无反应活性。对照实验表明,去除酶催化剂或用牛血清白蛋白(BSA)替代CvPAH时仅得到外消旋产物;铁、钴、镍等金属仅产生痕量产物,凸显出铜在该转化中的不可替代性。
在获得初始活性后,作者们通过定向进化改造CvPAH。该酶属于蝶呤依赖型芳香族氨基酸羟化酶家族(AAAHs),其活性位点包含四氢生物蝶呤(BH4)辅因子结合域和柔性底物结合环(Fig. 2A)。结合CvPAH与铜-N-甲基苯胺复合物的分子动力学模拟,作者选择20个活性位点残基进行饱和突变(SSM)筛选。采用GC-MS初筛结合手性HPLC立体选择性验证的策略,优先保留ee值提升的突变体。在进化工程启动前,实验室已有突变体库筛选获得F107L/Y130P双突变体,其ee值提升至66%。以此为母本进行多轮SSM筛选,最终获得五重突变体CvPAH F107L/Y130S/W180A/P134L/Y179W(简称CvPAH-胺化酶),能以19%产率和94% ee值生成产物3a(Fig. 2B)。分子模拟显示,突变导致活性腔体积扩大1.4倍,形成单一扩增空腔更利于底物1a的容纳(Fig. 2C)。

(图片来源:Science)
在获得最终变体后,作者通过优化反应参数提高了产率。质谱分析表明,80%的NHPI酯1a通过氧化还原活化消耗,但仅16%转化为目标胺化产物。系统优化显示罗丹明B是最佳光催化剂,铜离子浓度过高会降低蛋白质稳定性。最终确立的最优条件为:1.25 mM硫酸铜、5.0 mM抗坏血酸、10 mM N-甲基苯胺、45 mM NHPI酯1a和100 μM罗丹明B,使用OD600 = 50的全细胞裂解液时,在4 oC下反应6-24小时,产物3a收率达92%,对映选择性为94% ee。对照实验证实CvPAH酶的关键作用,且粗酶液效果优于纯化蛋白。
底物拓展研究表明,NHPI酯芳环上的取代基显著影响反应效率(Fig. 3):对位异丁基导致产率和对映选择性下降(3f),苄位修饰产生明显差异(3g-3i),非苄基羧酸衍生物无反应活性(1b)。以1a为模型底物时,苯胺类胺化偶联部分的耐受性较好(产率 > 40%,ee > 90%),但苄胺会完全抑制反应并生成酰胺副产物5。该策略还可兼容四氯-N-羟基邻苯二甲酰亚胺酯9(产率60%,ee 90%)和Katritzky盐等自由基前体。此外,肟酯6则产生开环胺化产物7(产率5.1%,ee 42%)。虽然烷基胺适用性有限,但这些发现证明了CvPAH平台与多种自由基生成策略结合的潜力(Fig. 3)。

(图片来源:Science)
最后,作者通过一系列实验深入探究了这种光生物催化脱羧胺化反应的机理(Fig. 4)。研究发现,无论是外消旋还是手性NHPI底物,酶都能将其有效转化为非手性底物构建C-N键,且产物对映体过量始终保持在94% ee。自由基捕获实验和环丙基自由基钟底物实验证实了碳中心自由基的参与。荧光光谱分析表明,光激发态RhB*与抗坏血酸盐(AH−)之间最可能发生初始单电子转移,生成的RhB•−进一步将CvPAH中的Cu(II)还原为Cu(I)。色氨酸荧光淬灭实验显示CvPAH-胺化酶对Cu2+的结合亲和力(Kd = 2.52 μM)弱于野生型(Kd = 0.48 μM),且对6-生物蝶呤的结合能力也降低。关键突变研究表明,179位和180位残基对维持酶活性和立体选择性具有协同作用,且W179A突变使产率从92%降至8%,ee值从94%降至10%;而A179/W180双突变则几乎完全丧失酶活性。这些发现为理解该光酶催化体系的反应机制提供了重要依据,但关于自由基生成位点等具体机制仍需通过瞬态吸收光谱等进一步研究阐明。

(图片来源:Science)
总结
Xiongyi Huang,杨云芳和Yi Rao课题组提出了一种脱羧形成C‒N键的生物催化新策略,证实了多环芳烃羟化酶(PAHs)可作为对映选择性自由基C‒N成键的强大催化平台。首次实现了酶催化的自由基C(sp3)‒N偶联反应,填补了生物催化与合成催化之间的空白。通过将该金属酶平台与不同自由基生成机制相结合,有望实现多种自然界尚未发现的生物催化胺化反应。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn