

图片来源:J. Am. Chem. Soc.
正文
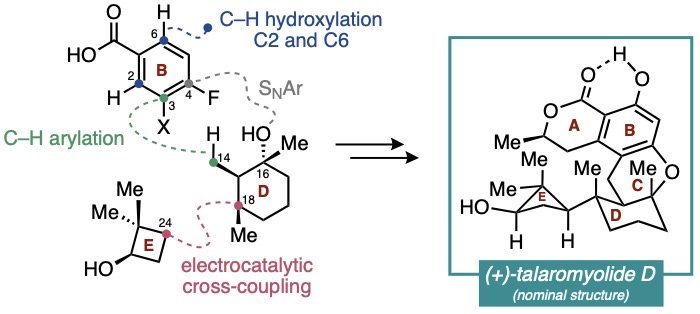
Talaromyolide A-D (1-4)是由海洋真菌Talaromyces sp. CX11产生的一类杂萜类天然产物。该系列化合物拥有类似的6/6/6稠合二氢异香豆素核心骨架,并以D/E环结构的差异加以区分。其中,talaromyolide D具有罕见的嵌在四个连续手性中心(且其一为季碳中心)中的二甲基环丁醇E环,增加了其全合成挑战性。此外,talaromyolide D(4)展现出显著的抗伪狂犬病毒(PRV)活性(CC50 3.35 μM)。复杂的结构及潜在的生物活性使talaromyolide D (4)的全合成极具价值。目前为止,尚无关于talaromyolides的全合成报道。近日,纽约大学Martin Tomanik课题组首次报道了(+)-talaromyolide D标称结构的不对称全合成。作者在逆合成分析(Figure 1)中提出talaromyolide D(4)中的A环内酯及C6位酚羟基可分别通过C1位羧基导向的串联C(sp2)-H烷基化/内酯化反应和C(sp2)-H氧化反应获得。中心C环则可由氟代苯11与三级醇10通过C(sp3)-H芳基化反应和分子内SNAr反应双重连接构建。三级醇10可由烯酮12经串联1,4-加成/烷基化,烯基化和水合反应制备。而烯酮12则可通过环丁烷衍生物13与烯基碘14在Baran课题组发展的镍催化的电化学偶联条件下获得(Figure 1)。
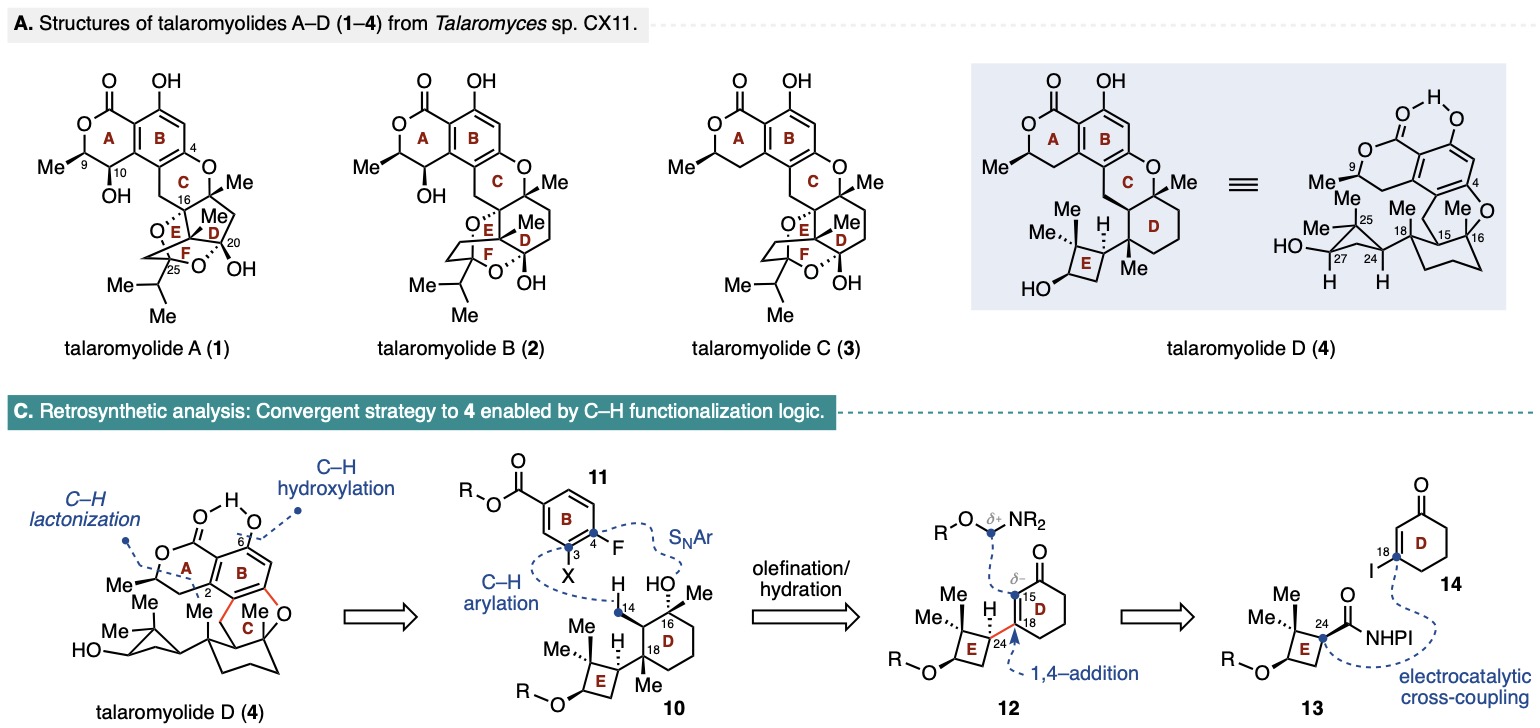
Figure 1. (A) Structures of talaromyolides A–D (1–4); (C) Retrosynthetic analysis of 4.
图片来源:J. Am. Chem. Soc.
作者以商业易得的原料(−)-verbenone (15)为起始 (Scheme 1)。首先通过Ru-NaIO4氧化裂解,Baeyer-Villiger氧化及EDC偶联,在十克级规模上以三步71%的总产率得到氧化还原活性酯16。随后,采用Baran课题组发展的镍催化的电化学偶联,成功将16与17偶联,以85%的产率(非对映异构体比例11:1)获得烯酮20及其非对映异构体。20的绝对构型由其衍生物21的单晶结构得以确认。值得注意的是,偶联过程中的立体保留可能源自于环丁烷自由基中间体18的优势构象。该构象使C27位乙酰氧基与C25位两个甲基的非键相互作用最小化,同时自由基SOMO轨道与临近C-C键重叠最大化。Ni(II)中间体19还原该自由基时,反应优先沿凸面进行,从而生成20。为验证这一假设,作者制备了酯16及其C-24位非对映异构体的混合物(Scheme 2),并在相同条件下进行偶联,所得产物显示出相同的非对映异构体比例,进一步证明中间体18为优势构象并决定了产物比例。
为实现后续C-H活化反应,需在C15和C18位置引入两个β-甲基。作者首先通过串联1,4-加成/烷基化及Cope消除反应,以两步73%的产率(非对映异构体比例3:1)获得烯酮23。进一步还原双键,并在酸性高温条件下异构化得到了热力学稳定的酮24(非对映异构体比例5:1)。随后,24与甲氧基胺缩合,并经MOM保护得到C-H活化前体26。利用陈超课题组发展的肟醚导向的C(sp3)-H芳基化反应,作者成功将肟醚26以82%的产率转化为27。由于肟醚基团所处空间位阻较大,其水解在多种条件下难以进行,最终作者发现通过低价钛试剂还原N-O键,再经硼酸水解所得亚胺中间体,可成功将27水解。产物酮经Wittig反应,三步以52%的产率获得烯烃29。随后,作者借助Armido Studer课题组发展的Mukaiyama类型的水合反应以单一异构体的形式得到相应三级醇中间体,产物与氢化钠共热至90 ℃,顺利发生分子内SNAr反应,成功构建起C环得到中间体30。
在获得关键中间体30后,需要通过系列C-H活化反应实现氧化态调控及内酯环的构建。作者首先将30水解为酸31,在余金权课题组发展的双齿配体L1-过氧化氢条件下,得到了C2和C6位的两种氧化产物。为实现选择性C6位的氧化,作者进一步尝试余课题组发展的双齿配体L2-氧气氧化条件,成功以大于20:1的异构体比例得到酚33。产物经甲基和苄基保护后水解为酸34。由于位阻较大,作者尝试余课题组发展的串联C-H烷基化/内酯化反应未得到目标产物(Scheme 2)。于是作者再次运用余课题组发展的L1-过氧化氢氧化,所得酚经甲基保护后生成酯39。39经三氟甲磺酰化和Stille偶联引入烯丙基得到40,随后通过Wacker氧化,CBS还原,和盐酸促进的内酯化/脱保护反应顺利构建A环得到38,最后经钯碳氢气还原脱苄,以99%的产率得到了(+)-talaromyolide D (4)。作者还通过X射线单晶衍射确证了合成产物的结构。
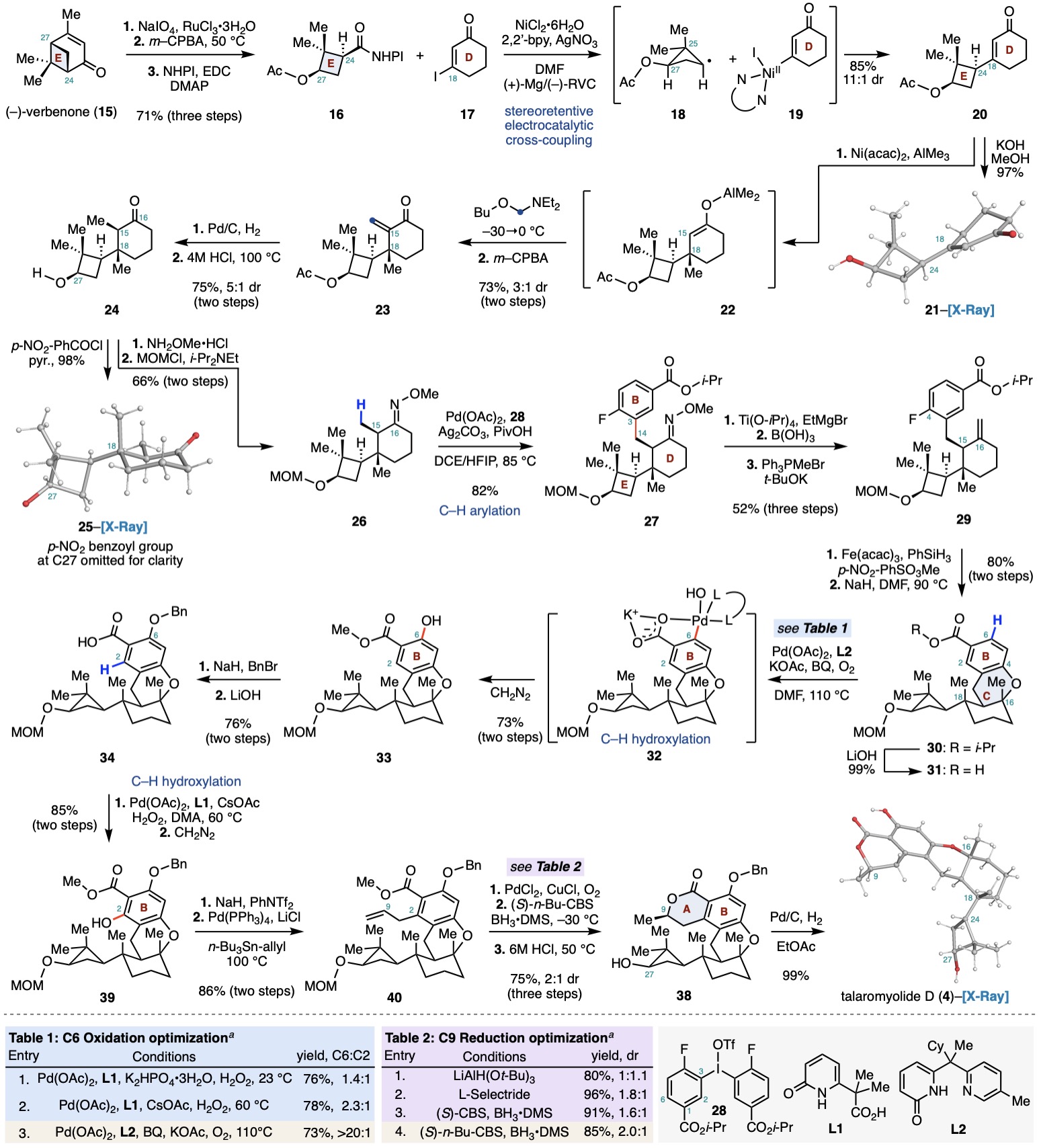
Scheme 1. Total synthesis of the nominal structure of (+)-talaromyolide D (4).
图片来源:J. Am. Chem. Soc.
在获得合成样品并完成结构确证后,作者注意到合成样品核磁数据与原始分离文献报道不符。为寻找正确分子结构,作者对各手性中心进行系统性调整,并利用密度泛函理论计算了33种可能异构体的13C核磁共振数据。结果表明,标称结构的计算值与合成样品核磁数据高度吻合,仅在C22位出现大于4 ppm的绝对误差(Scheme 2)。但是所有 33 种异构体的计算数据与原始分离文献报道的数据均存在显著偏差,其中至少有 5 个以上化学位移的绝对误差超过 4 ppm。这一结果表明原始分离文献在骨架结构的鉴定上可能存在错误。
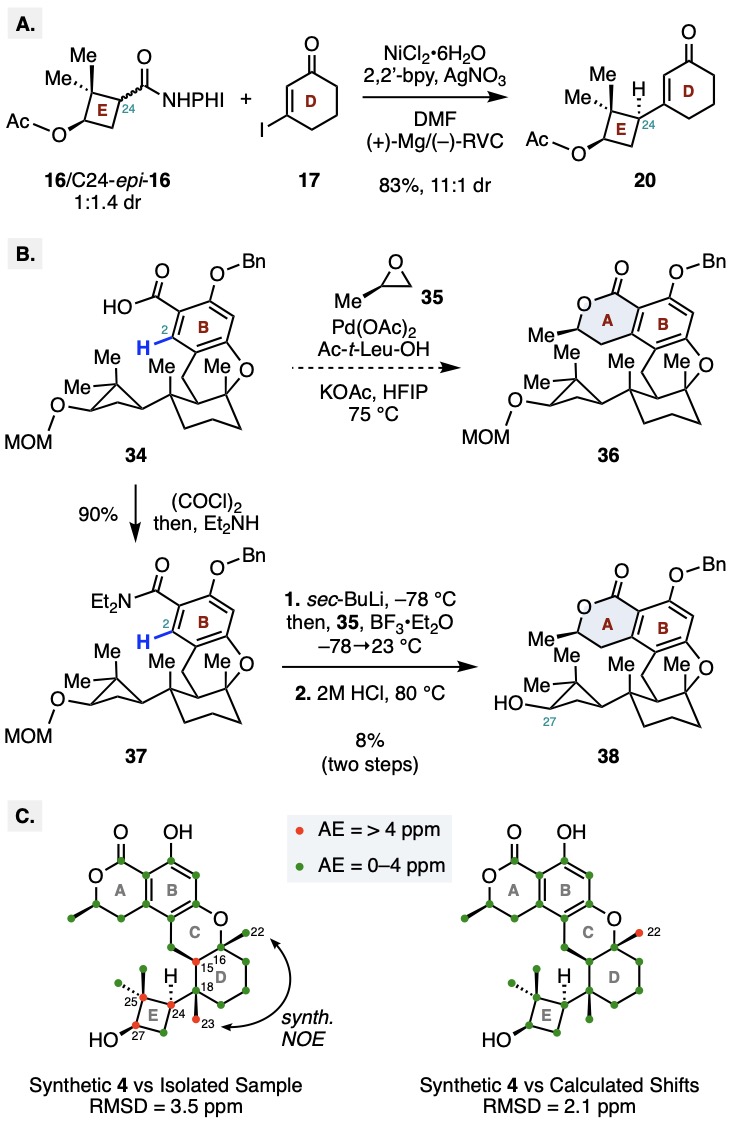
Scheme 2. (A) Electrochemical cross-coupling with a mixture of C24 diastereomers; (B) Selected efforts towards construction of the lactone A–ring of 4; (C) 13C NMR comparison data between isolated and synthetic talaromyolide D samples.
图片来源:J. Am. Chem. Soc.
总结
纽约大学Martin Tomanik课题组以27步反应首次完成了(+)-talaromyolide D标称结构的不对称全合成。该合成巧妙运的用了三次钯催化的C-H活化反应以调控氧化态并构建A/C环,借助立体保留的镍催化的电化学脱羧交叉偶联实现E/D环的构建,采用高度非对映选择性的铁催化 Mukaiyama 型烯烃水合反应,以及分子内 SNAr 反应构建中心C环。作者还通过密度泛函计算指出了原始文献结构鉴定可能存在骨架错误,为后续结构修正提供了参考。
作者简介
Martin obtained his PhD at Yale University under the mentorship of Prof. Seth Herzon, focusing on natural product total synthesis. In the summer of 2021, Martin moved to San Diego to pursue postdoctoral research in the laboratory of Prof. Jin-Quan Yu at The Scripps Research Institute. In 2023, he then joined the faculty at New York University as an assistant professor in the Department of Chemistry, where his lab’s research focuses on the synthesis of complex bioactive natural products and the development of new synthetic methods leveraging C–H functionalization chemistry.
课题组主页:https://www.tomaniklab.com。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn