

Nannocystin A是由赛诺菲制药公司及诺华生物医药研究所同时从myxobacterial genus, Nannocystis sp.中发现得到的一种大环酯肽类化合物,具有一个21元大环,环上包含了肽和聚酮结构(peptide and polyketide domains),还包含了几个高度修饰的氨基酸、共轭二烯结构以及带有环氧的酰胺,整个分子包含9个手性中心,其结构和立体化学由核磁谱图、单晶以及化学降解所确定。Nannocystin A在nM浓度范围内对许多人类癌症细胞系表现出了强大的生长抑制活性,显然,它是新型抗癌药物研发中一个很有前途的先导化合物。
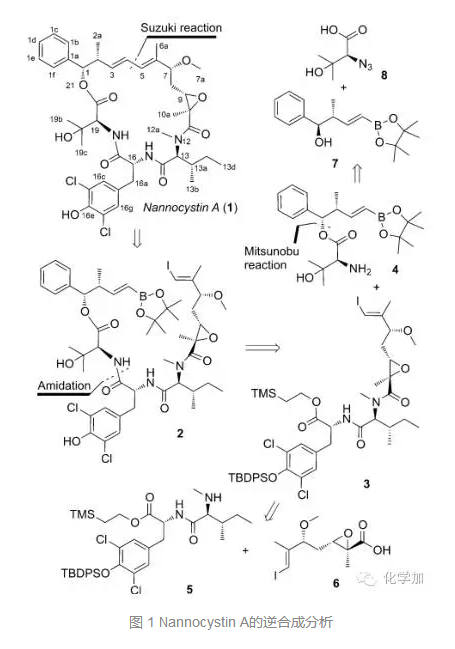
基于对分子结构的解析,作者提出了如图1所示的逆合成分析:从分子中的共轭二烯处切断,可以由Suzuki偶联反应构建,这样逆推至带有硼酸酯和烯基碘的化合物2, 2从17-18位处的酰胺键处切断,逆推至化合物4和化合物3, 4可以由化合物7和8经Mitsunobu反应酯化得到,而化合物3由5和6合成。
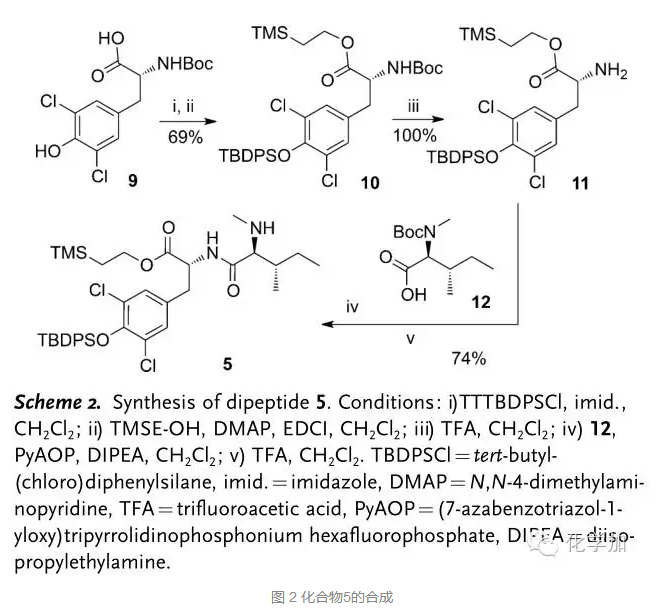
具体合成路线如下:从商品化原料9出发,先用大位阻较稳定的硅保护基TBDPS保护酚羟基,接着2-三甲基硅基乙醇和羧酸反应成酯得到化合物10,三氟乙酸脱去氮上Boc保护基得到胺化合物11, 11和氮Boc保护氮甲基的异亮氨酸12发生缩合成肽,接着脱去氮上Boc保护基,总共五步得二肽化合物5。
另一方面,从带有Evans辅基的化合物13出发,和醛化合物14发生插烯Mukaiyama Aldol 反应得到化合物15,在Meerwein盐 (Me3OBF4 )和质子海绵条件下甲基保护新产生的羟基,硼氢化锂还原脱去Evans辅基,Sharpless环氧化以89%的收率得到环氧羟基化合物17,DMP氧化接着Pinnick氧化得到羧酸化合物6,再在2-溴-1-乙基吡啶的四氟硼酸盐2-bromo-1-ethyl pyridinium tetrafluoroborate (BEP)作用下和化合物5缩合成肽得到二肽化合物3。
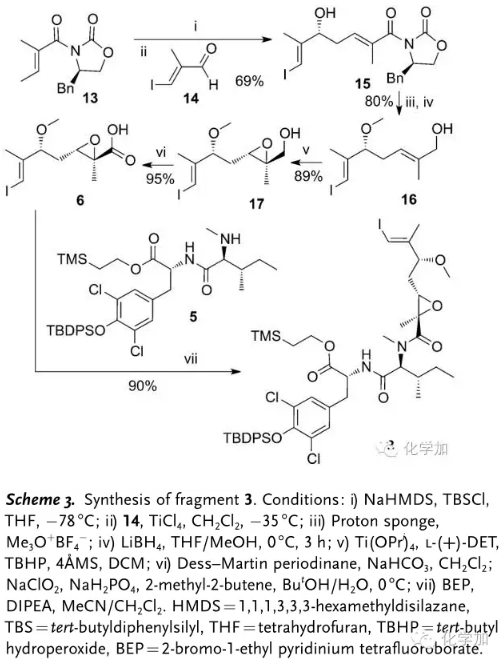
图 3 化合物3的合成
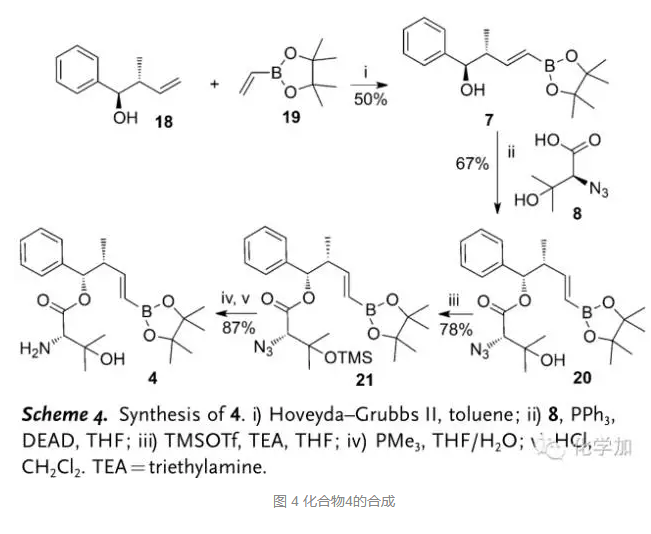
与此同时,从已知化合物18出发,首先和硼酸酯化合物19在Hoveyda–Grubbs二代催化剂的条件下发生烯烃交叉复分解反应得到化合物7,Mitsunobu条件下和化合物8发生酯化反应得到化合物20,TMS保护三级羟基,Staudinger反应将叠氮转化为胺基,盐酸条件下脱去TMS保护得到化合物4,为Suzuki反应做好了准备。
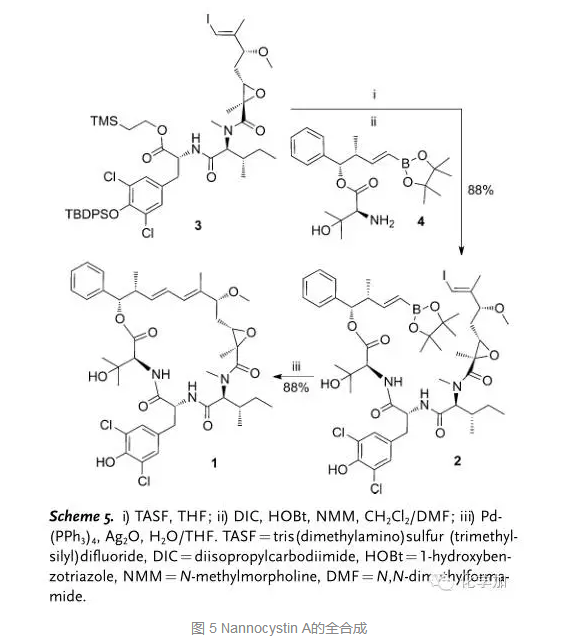
最后,化合物3先脱去2-三甲基硅基乙酯成酸接着和化合物4在HOBt缩合剂参与下发生反应得到三肽化合物2,Ag2O 和 Pd(PPh3)4条件下发生分子内Suzuki反应以88%的收率得到目标产物Nannocystin A。氢谱和碳谱与分离文献完全吻合,这样也进一步确定了分子的结构及相对立体化学。接着作者还进行了生物活性方面的测试,化合物1对于结肠癌细胞株和肝癌细胞株都表现出了纳摩尔级别的活性(例如对于SMMC7721,1.2 nm;对于Hep3B,0.5 nm)
总结
叶涛、许正双课题组设计了一条高效、简洁的汇聚式合成路线,完成了天然产物Nannocystin A的首例全合成。全合成中采取了插烯Mukaiyama aldol 反应,烯烃交叉复分解反应和分子内Suzuki偶联等反应作为关键步骤,各种缩合剂的使用也保证了肽键的顺利形成,这些反应都是环酯肽合成中经典的反应。生物活性筛选发现Nannocystin A对于大多癌细胞系均具有纳摩尔级别的活性,这为先导化合物的新药研发打下了坚实的基础。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn