

在不对称催化过程中,实现具有多个活性位点的选择性活化和对反应物的官能化一直是具有很大挑战性的工作。而不饱和羰基化合物具有多个反应位点作为潜在的合成子被广泛的应用于天然产物的合成中并受到有机合成化学家的青睐。环状α,β-不饱和酮在胺类有机催化剂作用下可形成A1-A4几种中间体并分别实现不同位置的官能化。其中,具有挑战性的是选择性的实现远端γ’位而不是γ位的活化,同时达到高水平的立体化学控制。因此,叶金星课题组首次报道了γ’位选择性活化环状不饱和酮与3-取代马来酰亚胺的[4+2]环加成/逆Mannich反应构建含季碳手性中心化合物的最新进展。
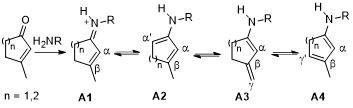
图1. 环状不饱和酮与有机催化剂形成亚胺离子与二烯胺中间体
经过对亲二烯体的筛选,作者选取了3-甲基-马来酰亚胺3a与3-甲基-环戊烯酮2a作为模板底物进行条件优化,并得到γ’位官能化同时在3-甲基-马来酰亚胺3a的C3位置产生一个季碳手性中心的产物4a。经过对伯胺类催化剂、苯甲酸类添加物、溶剂和温度的优化得到了最优反应条件:以20 mol% 1c作催化剂、添加40 mol%苯甲酸,甲苯作溶剂在40 oC下可以得到优秀的非对映-/对映选择性产物(图2)。
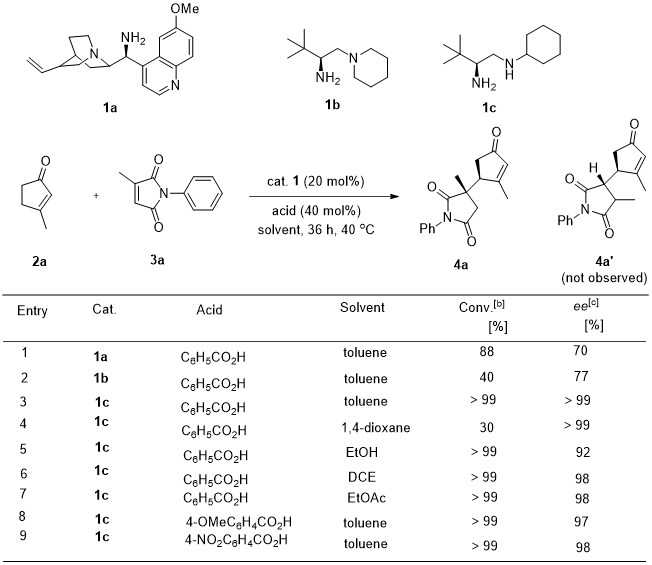
图2. 反应条件的优化
得到最优条件后,紧接着考察反应底物的普适性,可以看到,在环状不饱和酮的3-位和马来酰亚胺的3-位各种取代基团(包括甲基、芳基和苯乙烯基等)均能得到90% - > 99%以上的对映选择性;同时,N上的取代基也可以是氢、甲基或芳基而不影响反应的ee值,产物的结构也经X-射线单晶分析确定(图3)。
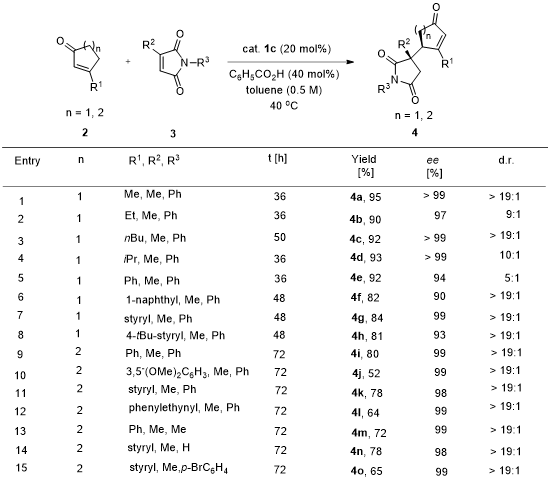
图3. 底物的扩展1
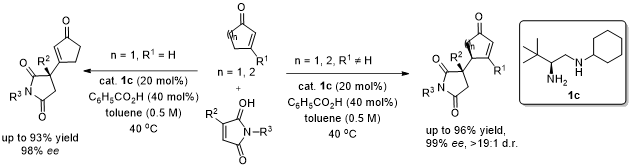
令人惊讶的是,对于2-环戊烯酮与3-取代马来酰亚胺的反应得到β-取代的环戊烯酮产物5而不是γ’位取代2-环戊烯酮的产物5’,同时在C3位形成季碳手性中心。对于马来酰亚胺3位取代和N上取代基的考察发现,均能保持95%-98%的ee值和87%-93%的收率(图4)。
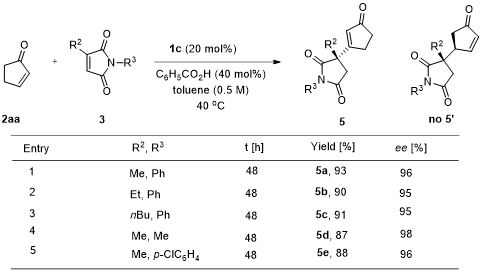
图4. 2-环戊烯酮与3-取代马来酰亚胺的底物扩展
最后,作者经过对反应过程的DFT计算并提出可能的反应机理:首先,反应底物在催化剂作用下经[4+2]环加成/逆Mannich反应形成中间体I1,然后I1经质子化形成中间体I2,I2进一步质子化得到I3,I3与I2或I4处于平衡转化过程,最终由β位质子化生成中间体I5,I5经水解得到目的产物5a。
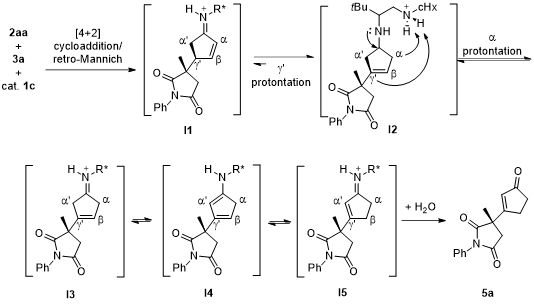
图5. 可能的反应机理
总结
叶金星课题组实现了有机催化环状不饱和酮与3-取代马来酰亚胺经[4+2]环加成/逆Mannich反应的γ’位选择性活化。该方法以高的收率和非常优秀的对映选择性得到环状不饱和酮C4邻位为手性季碳中心的3,4-二取代环状不饱和酮化合物,同时实现环状不饱和酮C3邻位含手性季碳中心化合物的构建。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn