


谢卫青博士2002年毕业于兰州大学,获理学学士学位。2007年于上海有机所获得博士学位,导师马大为研究员。毕业之后留在上海有机所,任助理研究员。2009年赴美国西南医学中心开展博士后研究工作。2011年重新回到上海有机所任副研究员。2015年作为青年英才引入西北农林科技大学,任教授、博士生导师。主要研究方向为有机小分子催化的不对称反应及其在天然产物全合成中的应用、具有重要生理活性天然产物合成、基于天然产物的化学生物学研究等。
众所周知,在化学分子中,结构决定着性质,性质决定着用途。许多具有重要生理活性的天然产物分子就是依赖于它们独特的三维化学结构,尤其是当分子中有季碳存在的时候,季碳会对分子结构有重要的影响。有时候,有的系列天然产物都会具有季碳或者连续的季碳如天然产物communesin F,perophoramidine, tochuinyl acetate和herbertenolide中都具有连续的手性季碳(图1)。
图 1 具有连续季碳手性中心的天然产物
而对于手性季碳的构建一直都是有机合成化学中的难点,也面临着诸多挑战。
传统的构建季碳的方法包括周环反应、烷基化反应、过渡金属催化的反应以及自由基反应等,但这大多数方法构建一个季碳比较有效,要是构建不同连续的季碳,仍然需要开发新的方法。
近期,有人报道了通过光解脱羧构建连续季碳的方法(图 2a),但底物比较受限。本文作者则是希望在他们课题组氧化去甲酰化反应的基础上,邻位带有甲酰基的酮化合物3在双氧水氧化作用下,脱去甲酸并分子内重排,发生缩环反应从而构建了连续的两个季碳,得到化合物5,可能的副反应则是另一种重排方式得到开链的二酸化合物6(图 2b)。
图 2 作者构建连续季碳的设想
首先,作者以一系列α-位带有甲酰基的环己酮为底物,在乙酸乙酯作溶剂,加入双氧水并室温反应的条件下,对该氧化缩环反应的底物中取代基进行了研究,发现α-位不带有取代基时反应不能发生,一侧α-位带有取代基且为季碳时缩环反应发生,得到带有一个季碳中心的五元环,但同时生成大量开链的副产物。只有当羰基两侧α-位都带有取代基,且都为季碳时,才能以良好的收率得到缩环产物。
图 3 底物中取代基的影响
接着,作者对该反应的底物进行了扩展,可以看出,当底物为带有螺环结构的环己酮时(3e-3l),能以非常优秀的产率和区域选择性得到带有连续两个季碳手性中心的五元环化合物。而对于非环状的羰基两侧α-位带有取代基且为季碳的底物(3d,3m,3n,3o)时产率良好,但选择性明显下降。值得一提的时,桥环底物3p能以优秀的产率和选择性得到非常有用的带有连续两个手性中心的5-6并环产物,且产物中的羧基和双键都可以进一步衍生化。而对于羰基一侧α-位带有叔碳或者不是手性中心的底物(3c,3q,3r,3s-v)也能以中等到优良的产率得到相应的缩环产物。
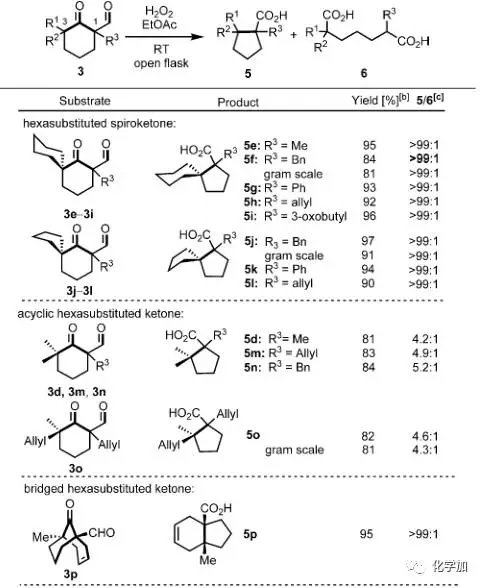
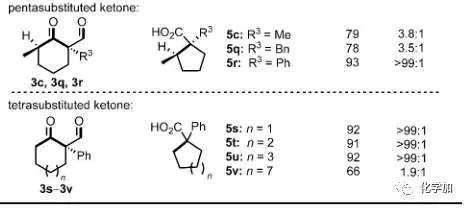
图 4 底物的扩展
另外,作者还研究了该反应的手性保持情况,从手性纯的底物3出发,在标准氧化缩环条件下,产物都能以良好到优秀的ee值使手性保持(图 5)。
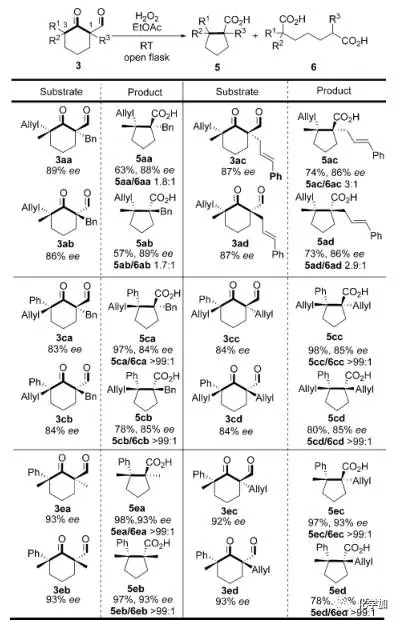
图 5 反应的手性保持研究
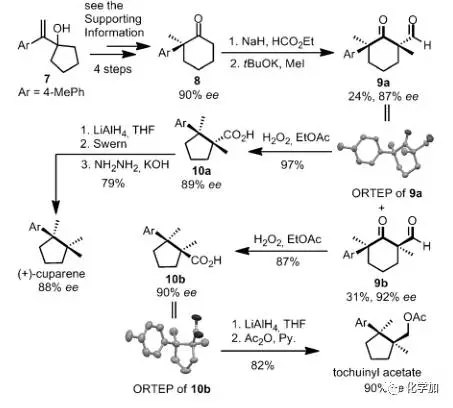
图 6 氧化缩环反应的应用
为了研究该反应的实用性,作者从已知原料7出发,合成了手性酮化合物8,在羰基的另一侧α-位装上甲酰基和甲基得到9a和其差向异构体9b,再分别在双氧水、乙酸乙酯条件下以优秀的产率得到缩环产物10a和10b, 再分别经过三步和两步简单的转化就可以合成两个带有连续季碳手性中心的天然产物(图 6)。
总结
谢卫青教授课题组报道了他们通过双氧水条件下的氧化缩环反应,构建了连续的手性季碳,该反应条件温和,产率优良,在连续季碳中心的构建以及天然产物的合成中具有重要应用价值。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn