

从菊科植物中分离得到的倍半萜内酯是一大类具有重要生物活性的植物次生代谢产物,特别是具有α-亚甲基-γ-内酯结构的那些倍半萜内酯表现出了强大的抗癌、抗炎、抗偏头痛活性和杀虫活性,其中许多天然产物还具有抑制NF-ĸB信号通道的作用,这对于一些炎症、自身免疫疾病以及癌症的研究都具有重要意义。
5,7-并环的愈创木内酯(guaianolides)是倍半萜内酯的一个重要子集,包括6,12-愈创木内酯和8,12-愈创木内酯两种亚型,其中对于8,12-愈创木内酯型天然产物的研究还相对较少。
(+ )-Mikanokryptin是Herz等人1975年分离得到的8,12-愈创木内酯型天然产物,结构如图1所示,具有5-7-5并环结构,其中七元环上具有连续的手性中心。
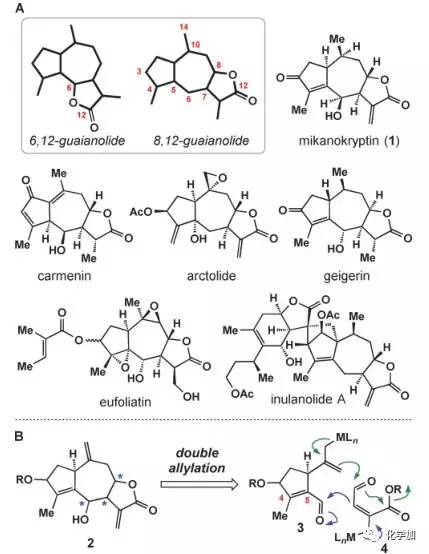
图 1 目标产物结构及合成设想
如图1B所示,作者希望通过两次烯丙基化反应构建其中的七元环和五元内酯环,进而完成目标产物的全合成。
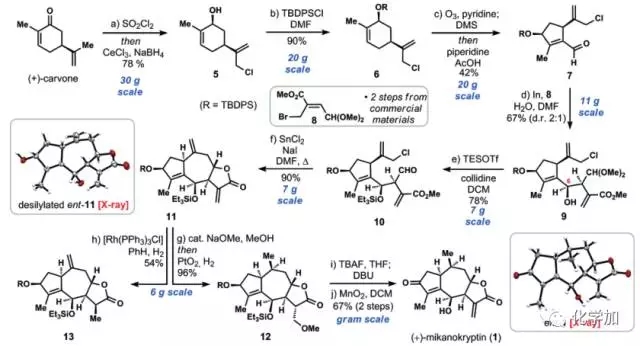
图 2 合成路线
具体合成路线如图2所示,从商品化手性原料香芹酮出发,氯代并Luche还原,以78%的收率得到烯丙醇化合物5,可以30克规模制备。TBDPS(叔丁基二苯基硅基)保护烯丙位羟基得到化合物6,吡啶存在条件下选择性臭氧化切断六元环上三取代双键,并发生分子内缩合反应得到五元环的α,β-不饱和醛化合物7, 再在金属铟存在下和化合物8发生烯丙基化反应,该反应中需要1当量水的加入来阻止原位的内酯化,以2:1的dr值得到化合物9,TESOTf和collidine(2,4,6-三甲基吡啶)条件下保护6-位的烯丙基羟基并脱去了缩醛保护基得到化合物10。
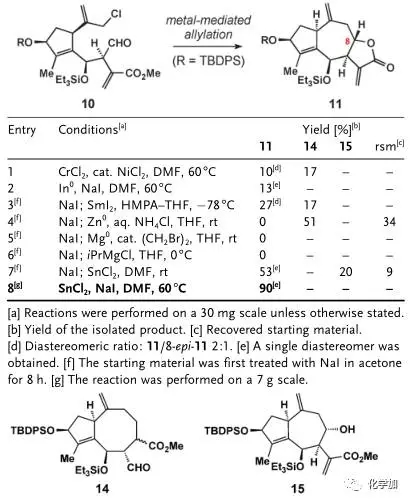
图 3 第二个烯丙基化反应条件筛选
如图3,通过条件筛选,化合物10再在氯化亚锡、碘化钠条件下发生第二个烯丙基化反应,并原位内酯化得到三环化合物11(entry 8,其它条件会得到八元环产物14或者没有关上五元环内酯的产物15),其结构和立体化学由单晶予以确证。接下来就是官能团的修饰,作者希望在[Rh(PPh3)3Cl]条件下氢化掉七元环的环外端烯,但只得到了五元环环外双键被氢化的化合物13,因此先在甲醇钠甲醇条件下先发生Michael反应保护住五元环内酯的环外双键,再在二氧化铂氢气条件下氢化掉七元环环外端烯得到化合物12,TBAF脱去两个硅保护基,并在DBU条件下发生β-位消除又得到五元环内酯的环外双键,最后二氧化锰氧化左边五元环上的烯丙基羟基便得到了最终的目标产物(+ )-Mikanokryptin,并由单晶确定了其结构和立体化学,整条路线最长线性步骤10步,总产率6%,并且可以克级规模制备。
总结
Maimone课题组利用两次烯丙基化反应为关键步骤,总共10步,6%的总收率简洁高效地完成了倍半萜内酯(+ )-Mikanokryptin的全合成,并实现了克级规模的制备,这对于该系列的倍半萜内酯的全合成以及进一步的生物活性研究都具有重要意义。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn