

第一篇Nature Chemistry是陈应春教授等发表的,陈应春教授(杰青)主要从事新型手性有机催化剂的设计、合成及不对称催化反应研究以及生理活性物质的设计、合成等方面的工作。在前期工作的基础上,陈应春教授和第三军医大学欧阳勤副教授等人通过选择不同的小分子添加剂和反应物,实现了环戊烯酮类底物的分子间[6+2]、[4+2]和[2+2]不对称环加成反应,且这三种环加成反应都取得了良好的产率和优秀的区域选择性以及立体选择性,文章DOI: 10.1038/NCHEM.2698。
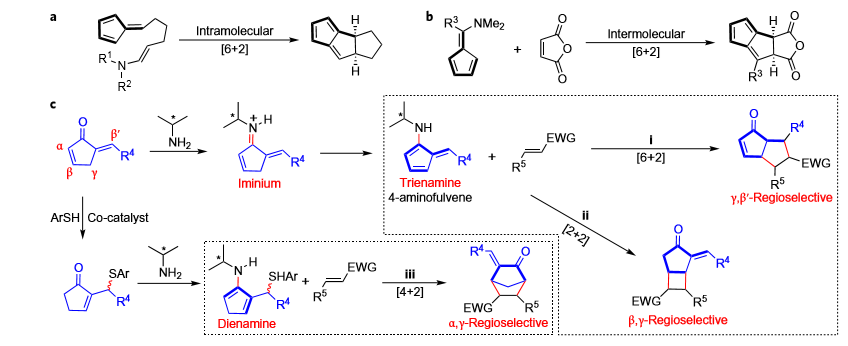
图 1 环戊烯酮类底物的分子间[6+2]、[4+2]和[2+2]不对称环加成反应
作者发现选用有机胺催化剂C1或者C3,邻羟基苯甲酸A1作添加剂,甲苯中50度反应,可实现环戊烯酮化合物1和不饱和烯烃2的分子间区域选择性[6+2]反应。甲氧甲基,卤素,烷基,氰基,硝基等取代基都可以兼容,表现出了良好的底物适用性。
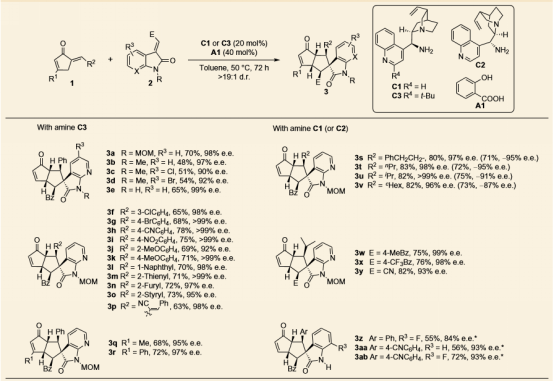
图 2 环戊烯酮类底物的分子间[6+2]反应及底物扩展
对于同样的反应物,当选用邻巯基苯甲酸A2作添加剂时,则能以优秀的产率和立体选择性得到[4+2]环加成产物4a。通过将1a与A2预先处理得到含硫中间体5,加入2a和催化剂C2,反应能以良好的产率和立体选择性得到产物4a,质谱证明了该[4+2]环加成反应是由C2和A2共同催化实现的。在C1或C2催化剂下,20几个底物也都取得了良好的结果。当选用双不饱和的酮酯化合物和环戊烯酮1反应时,也都以良好的产率和选择性得到了桥环产物。
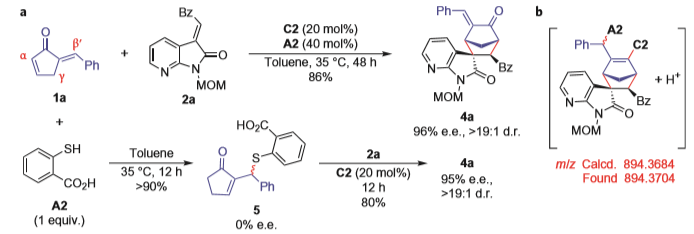
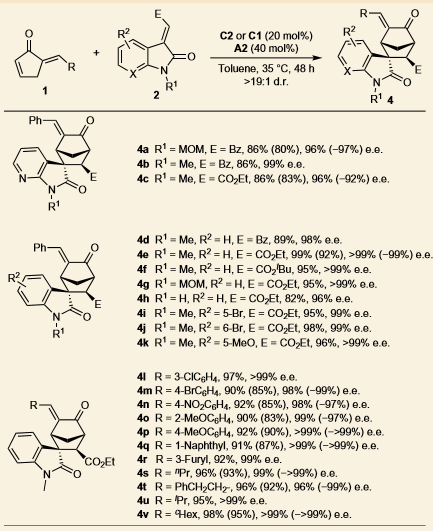
图 3 环戊烯酮类底物的分子间[4+2]反应及底物扩展
作者还发现当使用马来酰亚胺类作为烯烃组分,可以和环戊烯酮1发生区域选择性的[2+2]反应,产物经过氧化、氢化还原后,能以良好的产率和非常优秀的选择性得到六元环内酯的结构。
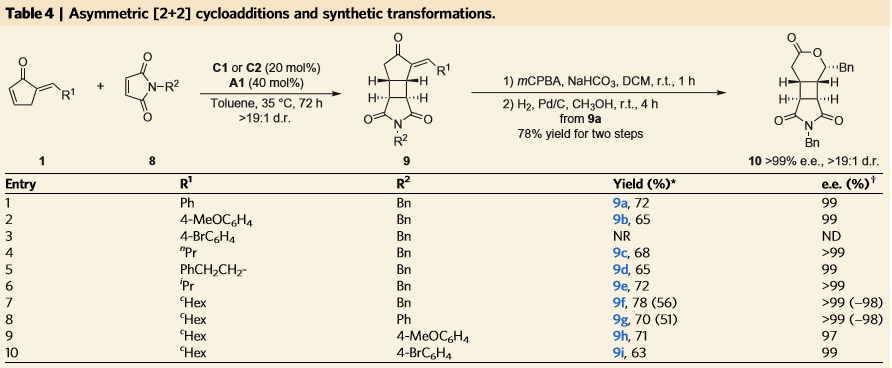
图 4 环戊烯酮类底物的分子间[2+2]反应及底物扩展
第二篇Nature Chemistry是南开大学化学院的汤平平(青年千人)课题组发表的三氟甲氧基化反应方面的重要文章,作者利用三氟甲氧基磺酸酯trifluoromethyl arylsulfonate (TFMS)作为新的三氟甲氧基化试剂,在银催化下实现了烯烃的分子间不对称溴-三氟甲氧基化反应。TFMS比其它传统的三氟甲氧基化试剂更易于制备,且比较稳定,同时具有良好的反应性,不仅在简单底物中取得了良好的结果,就是在复杂的天然产物及其类似物中,其中的双键也能很好的发生不对称溴-三氟甲氧基化反应,实现衍生化,为药物改造打下了坚实的基础。文章DOI: 10.1038/NCHEM.2711。
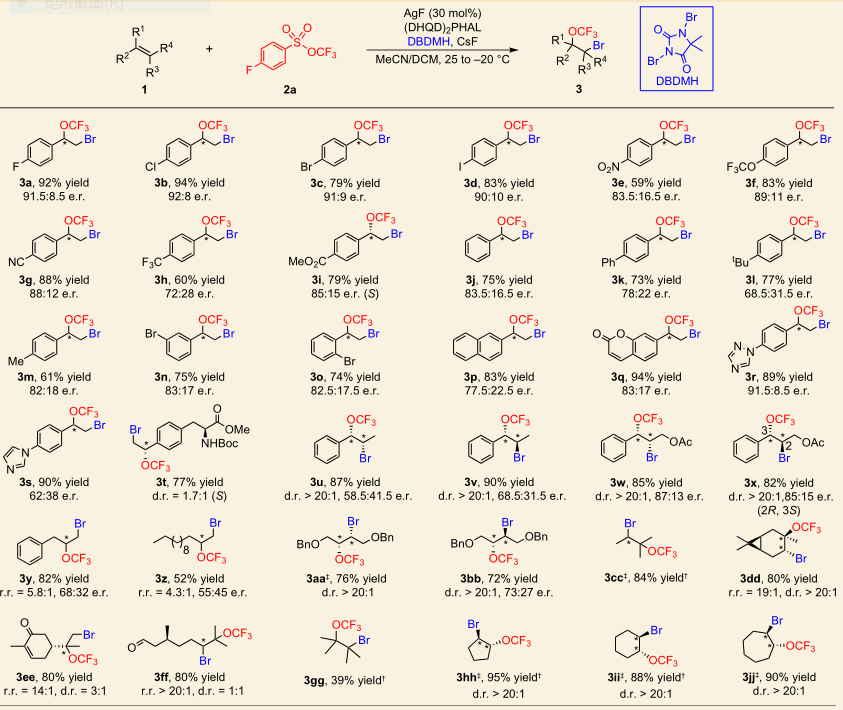
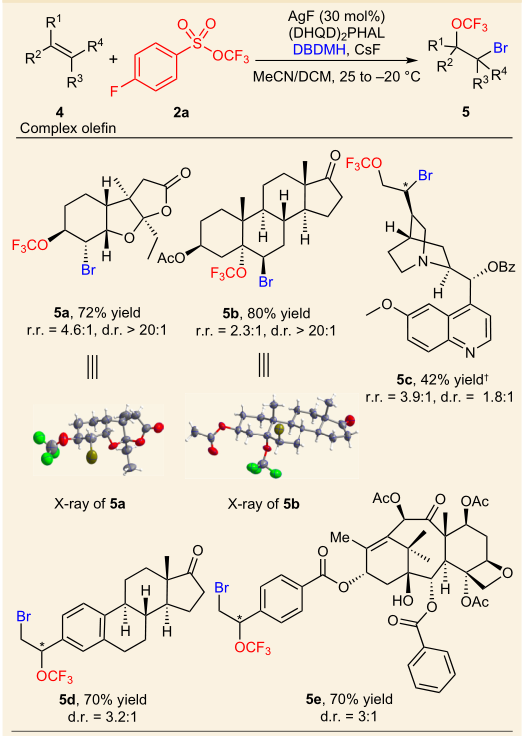
图 5 烯烃的分子间不对称溴-三氟甲氧基化反应及底物扩展
第三篇Nature Chemistry是南开大学物理学院的王慧田(长江学者)、周向锋课题组联合其他课题组共同发表的(王慧田教授、周向锋教授是共同通讯作者,本文通讯作者还包括纽约州立大学石溪分校的Artem R. Oganov)关于氦化合物的文章。文章DOI: 10.1038/NCHEM.2716。
由于氦原子外壳层s轨道和p轨道都是全满的状态,没有空间和其他原子通过共用电子结合成键。但这只是氦在地球表面环境中的情况,本文的研究人员通过“晶体结构预测”模型进行演算发现,在极度的压力之下,一种稳定的氦钠化合物可能会形成。然后他们在金刚石压腔实验中真的合成并检测出了新的化合物Na2He。据悉该成果在发表的时候遇到了巨大的困难,研究人员花了两年多的时间去说服审稿人和编辑。这个钠氦化合物呈萤石(CaF2)型结构,是一种面心立方结构。由图6中的球棍模型可以发现,He填充在8个Na组成的小立方体中心。研究人员发现,Na2He是一种电子晶体,并不是由传统意义上的化学键连接的,随着He插入到Na中,对电子云产生了推力,将共价电子对固定在特定区域,一种八中心两电子的稳定结构由此形成。Na2He在压强超过113 Gpa时能够保持稳定,在140 Kpa下,实验发现Na2He的熔点要比纯Na要高。
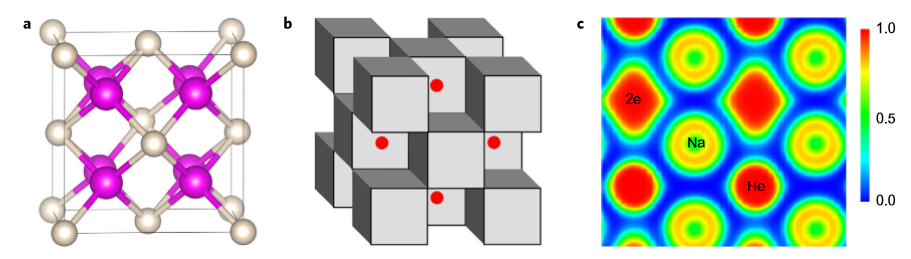
图 6 Na2He在300 Gpa时的晶体结构
当然,这个突破性的全新化合物还需要得到其他更多的独立实验的重复验证,比起最近饱受争议的金属氢,“这是更为可靠的科学,氦化合物是一项重大突破。”伦敦帝国学院的物理学家Henry Rzepa在把这项研究和金属氢的发现对比是如是说道。
不管怎样,这些工作都是我国学者在化学领域取得的突破性成果,工作量大、工作难度高、创新性强,令人敬佩,期望17年我国化学界有更多优秀的文章17出现。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn