

如图1所示,communesin家族天然产物是从海洋或者陆地的青霉属真菌中分离得到的多环吲哚生物碱,它们具有显著的细胞毒性和杀虫活性。这些生物碱具有相似的挑战性的七环骨架,具有两个缩胺醛结构以及至少五个手性中心,其中有两个相邻的季碳中心。复杂的结构和显著的生物活性使得这些分子成为明星目标分子。
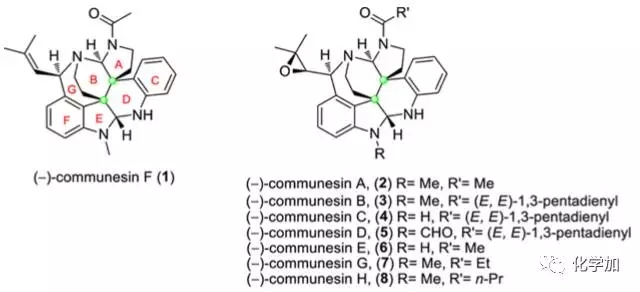
图 1 communesin家族天然产物
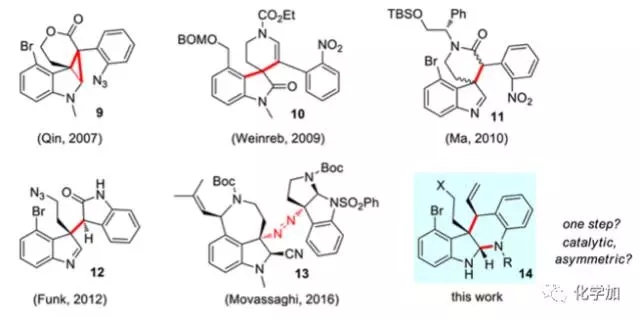
图 2 前人对于communesin F的合成报道
如图2所示,是前人对于communesin F的全合成报道,包括四川大学的秦勇教授(环丙烷化开环等为关键步骤)以及上海有机所的马大为研究员(氧化偶联反应等为关键步骤)。但截至目前,还没有以催化不对称的方式一步来构建缩胺醛结构的报道,而这也正是本文工作的研究重点和其特色。
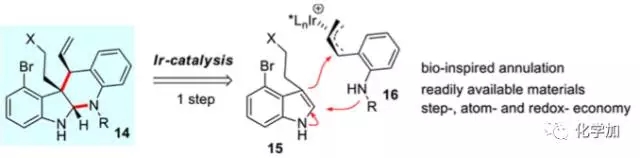
图 3 本文对于缩胺醛四环体系的合成设计
受启发于生源过程中的环化反应,作者期望通过一步铱催化的吲哚3-位烯丙基化反应进而缩胺醛化反应一步构建并环体系,显然这种设计具有原料易得,且符合原子经济性、步骤经济性及氧化还原经济性的特点。
首先,作者以3-位带有取代基的吲哚底物15a和苯胺类底物16为反应物,对反应条件进行了筛选,如图4所示,在钯催化条件下,主要得到线性的未环化产物21,换成铱催化剂,主要得到环化的缩胺醛产物14,并通过对添加剂、溶剂等的筛选,能以大于92%的ee值及大于10:1的14/21产物比例,以良好的产率得到四环产物14。
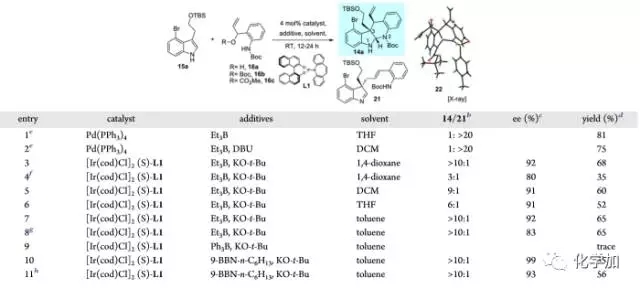
图 4 铱催化的关键反应条件筛选
从化合物14a出发,先对吲哚环上的氮原子甲基化,接着利用Mitsunobu条件将23中的羟基转化为保护的胺基,引入了氮原子,得到化合物24。对端烯进行双羟化并高碘酸钠切断,接着Pinnick氧化成酸,再酯化得到甲酯25,肼解脱去侧链氮上的邻苯二甲酰保护基,原位酰胺化并Boc保护得到化合物26,内酰胺羰基α-位烯丙基化,并脱去酰胺氮上的Boc保护基,端烯再双羟化、高碘酸钠切断、硼氢化钠还原得到化合物29,其结构和立体化学由单晶予以确证。
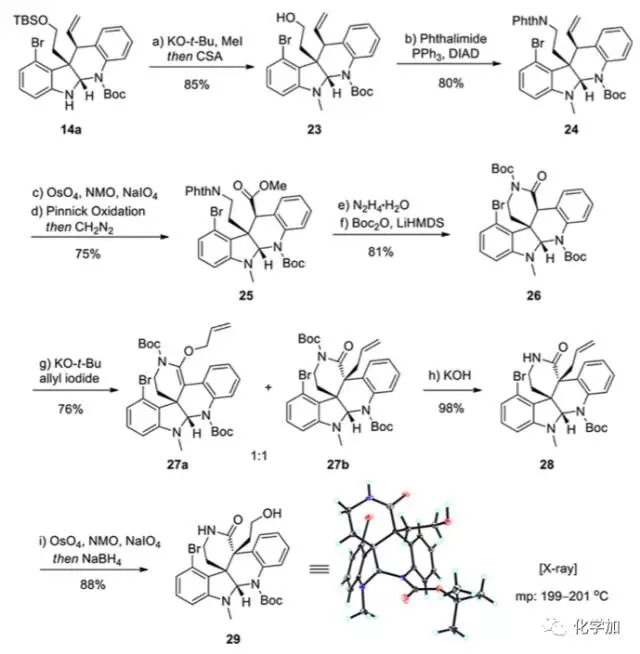
图 5 关键中间体29的合成
从化合物29出发,作者尝试了对于七环体系的构建,首先还是利用Mitsunobu条件将29中的羟基转化为保护的胺基,引入氮原子,得到化合物30。接着Heck反应引入带有叔醇的侧链,在MsCl、Et3N条件下发生SN2’反应得到化合物32,肼解脱去邻苯二甲酰保护基同时内酰胺交换得到五元环内酰胺化合物33,但无法进一步关环。
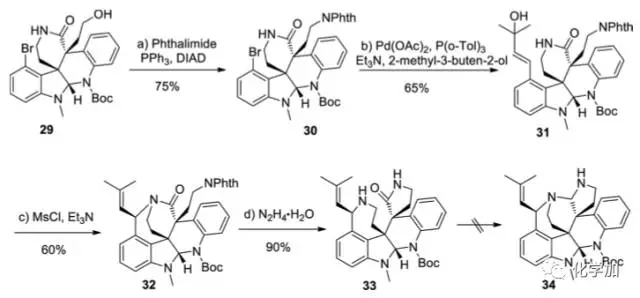
图 6 对于七环体系的合成尝试
改变策略,先从化合物30出发,首先肼解除去邻苯二甲酰保护基,并用乙酰基对胺基进行保护得到化合物35,再Heck反应、SN2’反应得到化合物36,氢化铝锂还原内酰胺,并用甲磺酰基保护得到化合物38,经亚胺中间体发生缩胺醛化反应,最后在三氟乙酸条件下脱去氮上Boc保护基,完成了天然产物communesin F的全合成,其旋光数据和分离文献中一致。
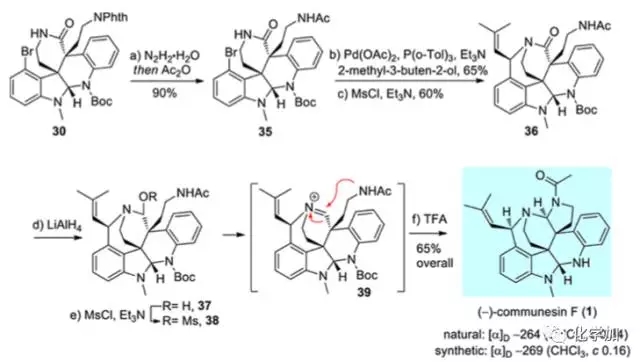
图 7 Communesin F的催化不对称全合成
总结
杨玉荣课题组简洁高效地完成了Communesin F的催化不对称全合成,其关键反应是铱催化的烯丙基化反应/环化反应对下方含有缩胺醛结构的四环体系一步仿生构建,该串联反应具有高度选择性(对映选择性、非对映选择性,区域选择性)和步骤经济性、原子经济性及氧化还原经济性的优点。在全合成最后阶段,将扭曲酰胺还原为O, N-hemiaminal,甲磺酰化伴随亚胺离子的环化反应得到复杂七环骨架。 整体路线非常优雅,这对于Communesin家族其它天然产物的合成也具有重要的借鉴意义。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn