


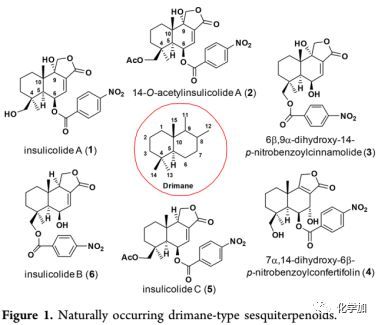
Insulicolide A(1)是一种稀有的硝基苯甲酰基取代的倍半萜类化合物(2-6, Figure 1),于1997年从海洋真菌Aspergillus insulicola中分离得到(J. Nat. Prod. 1997, 60, 811.),其结构通过X射线晶体学分析确证,该化合物具有独特的drimane型骨架,并且含有五个连续的立体中心,其中两个是四级碳(C-4和C-10)。Insulicolide A(1)对10种人癌细胞系(H1975,U937,K562,BGC-823,Molt-4,MCF-7,A549,Hela,HL60和Huh-7)均具有显著的细胞毒性,IC50值:2.11~6.35 μM。
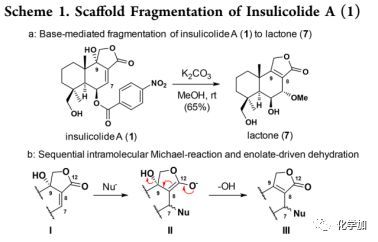
在温和碱性条件下,利用K2CO3/MeOH可将1转化成内酯7,表明1在C-7位易于进行亲核加成导致在C-9处羟基消除得到甲醚7,这可能是通过Michael加成和烯醇化脱水产生的(b in Scheme 1)。
Drimane型倍半萜是一类具有多种生物活性的天然产物。传统的合成方法主要采用串联多烯环化反应和分子内Diels-Alder反应构建三环母核结构。虽然insulicolide A具有显著的细胞毒性和独特的作用模式,但至今未见其全合成报道。近日,北京大学杨震教授与陈家华课题组联合在Organic Letters报道了insulicolide A和其他三个家族成员2,3和4的首次不对称和多样性全合成。
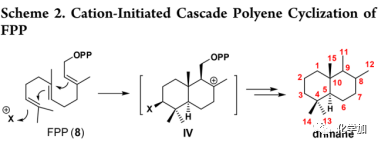
从生物合成上来看,drimane骨架可以由法尼基焦磷酸(farnesyl pyrophosphate ,FPP,8)通过阳离子引发的串联多烯环化经中间体IV来构建(Scheme 2)。
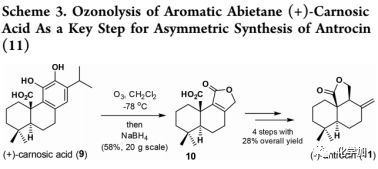
在2015年,作者曾开发出一种简洁的不对称合成方法,将松香烷(+)-carnosic acid(9)中富电子的酚进行臭氧分解得到中间10,再经四步反应合成(-)-antrocin(11)(Scheme 3)。作者拟以串联多烯环化和苯酚臭氧分解作为关键步骤,进行insulicolide A的不对称全合成,并希望开发的方法可以适用于其他家族成员的全合成。
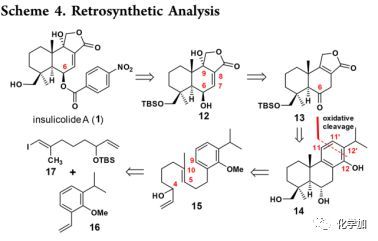
逆合成分析(Scheme 4):
Insulicolide A(1)可由二醇12经C-6羟基的苯甲酰化和脱TBS来合成,而12可以由内酯13通过其双键与H2O2/NaOH的环氧化以及碱介导的环氧开环,或者双键的双羟化以及新生成的C-8羟基脱水来构建。内酯13可通过苯酚14在C-11/C-11'和C-12/C-12'处进行C-C键的区域选择性氧化裂解产生,苯酚14则可以通过铱催化的对映选择性多烯环化串联反应从外消旋的烯丙基醇15合成,而15可以通过乙烯基碘17与取代苯乙烯16进行Suzuki偶联获得。
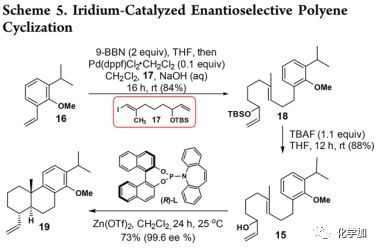
多烯15的合成以及多烯环化(Scheme 5):
首先,利用苯乙烯16与9-BBN反应得到硼酸酯中间体,然后在Pd催化下与乙烯基碘17进行Suzuki偶联得到18,进一步处理脱去TBS得到多烯15。随后,利用Carreira等人报道的反应条件探索了Lewis酸作用下铱催化的对映选择性多烯环化,并发现在20 mol%Zn(OTf)2存在情况下,环化收率可以达到73%(99.6%ee)。
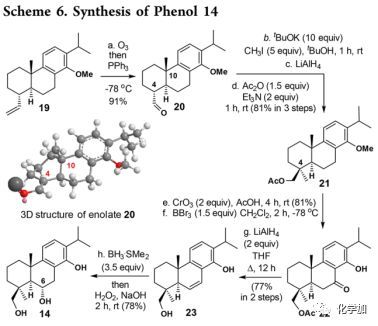
苯酚14的合成(Scheme 6):
化合物19经化学选择性臭氧分解得到的臭氧化物用Ph3P还原得到醛20,通过用t-BuOK/t-BuOH处理醛20来引入C-4季碳手性中心,并且将得到的烯醇化物与MeI反应,然后经LiAlH4还原和Ac2O乙酰化得到乙酸酯21。随后,经CrO3氧化、BBr3脱甲基得到酮22,然后用LiAlH4在THF中回流下处理22酮基经串联还原得到23。最后,通过硼氢化氧化实现区域和非对映选择性引入C-6羟基得到苯酚14(78%)。
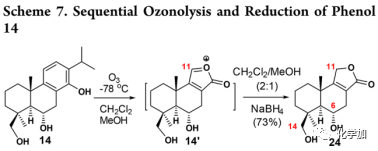
在得到苯酚14后,作者尝试将苯酚14通过臭氧裂解构建内酯24(Scheme 7):当苯酚14在-78 ℃、CH2Cl2/MeOH (2:1)条件下进行臭氧分解时,其通过两种臭氧化物进行双重臭氧分解以产生氧鎓离子14',然后经NaBH4还原,以一锅法操作得到产物24(73%)。
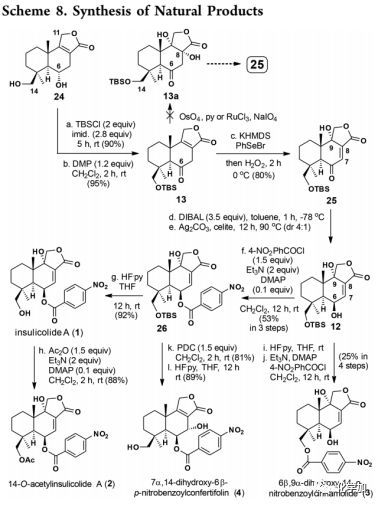
Insulicolide A(1)及2,3和4的全合成(Scheme 8):
在得到内酯24后,作者将目标转向天然产物的全合成,首先需要分别在C-6和C-9立体选择性引入两个羟基。将24中的伯醇用TBS选择性保护,仲醇用DMP氧化成相应的酮13。作者首先尝试了通过双羟化-脱水反应在25中引入C-9羟基,但13未发生双羟化。随后,作者探索了基于硒氧化物的[2,3]-σ迁移重排来合成25,即酮13经KHMDS处理后与PhSeBr反应得到的硒代苯基酮和H2O2反应生成硒氧化物,再进行[2,3]-σ迁移重排得到25。经DIBAL-H还原将酮和内酯部分还原为相应的醇和半缩醛,然后进行Fetizon氧化得到12(主要异构体)及其非对映异构体的混合物,不经分离直接进行苯甲酰化得到26(53%)及其非对映异构体(13%)。将26脱去TBS便得到insulicolide A(1);将1乙酰化得到14-O-acetylinsulicolide A(2);将底物12(作为一对C-6非对映异构体)脱TBS产生的三醇与4-NO2-PhCOCl反应以25%的收率得到6β,9α-dihydroxy-14-p-nitrobenzoyl-cinnamolide(3);在PDC的存在下,底物26发生1, 3-羟基迁移,所得产物脱TBS后以89%的收率得到7α,14-dihydroxy-6β-p-nitrobenzoylconfertifolin(4)。
小结:北京大学杨震教授与陈家华课题组以简洁、高效的路线完成了倍半萜类海洋天然产物insulicolide A(1), 14-O-acetylinsulicolide A(2), 6β,9α-dihydroxy-14-p-nitrobenzoyl-cinnamolide(3)和7a,14-dihydroxy-6β-p-nitrobenzoylconfertifolin(4)的首次不对称和多样式全合成。其关键合成步骤包括:(1)通过铱催化的对映多烯环化构建C-4和C-10位两个季碳手性中心;(2)利用苯酚环的串联臭氧分解构建目标分子的内酯片段。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn