

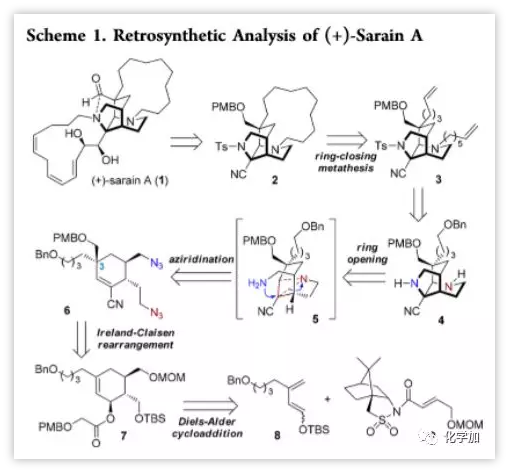
(+)-Sarain A(1)于1986年从一种海绵Reniera sarai中提取出,并被证明具有抗肿瘤、抗菌、杀虫和抗氧化活性。近年来,Overman课题组(2006)、Fukuyama课题组(2015)等分别报道了(+)-Sarain A的全合成,但作者别出心裁,将注意力放在其独特的四环骨架(2)上。作者设想通过8和9的Diels-Alder反应和Ireland-Claisen重排构建立体化学中心6,并引入叠氮构建氮杂环丙烷中间体5,通过氮的亲核开环构建骨架中的二氮杂三环十一烷核心(4),再引入烯基侧链进行RCM反应构建骨架中的十三元大环(2)(Scheme 1)。
图源:Org. Lett.
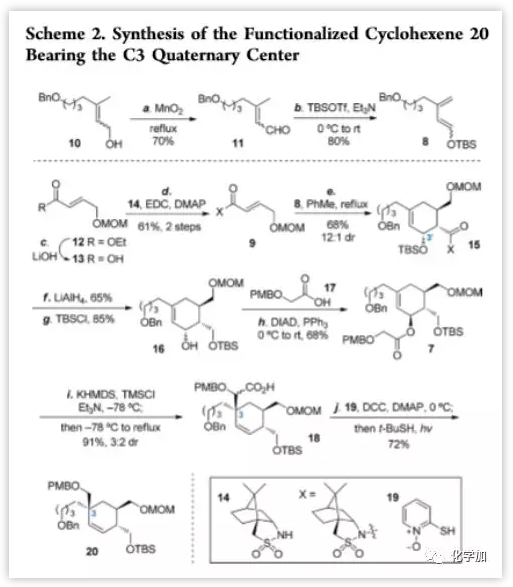
合成路线始于对逆合成分析中Diels-Alder反应的两个底物的制备(Scheme 2)。用二氧化锰氧化烯丙醇10,以70%的产率得到烯基醛11,再用TBSOTf和Et3N处理得到二烯8,产率为80%。接下来,作者将酯12用碱水解得到酸13,其与樟脑磺酸的手性助剂14通过EDC/DMAP进行偶联,以两步收率61%得到亲双烯体底物9,9与8在甲苯中回流,发生Diels-Alder反应,以66%的产率和12:1的dr选择性得到环己烯产物15。值得一提的是,Lewis酸(Et2AlCl, AlCl3, Sc(OTf)3等)不能引发这一D-A反应,因为8的硅基部分对Lewis酸敏感。用四氢铝锂处理15脱除手性助剂X和TBS保护基并还原羰基,再用TBSCl选择性保护伯醇得到16。16与酸17通过Mitsunobu反应发生构型翻转的酯化反应得到酯7,再在KHMDS / TMSCl / Et3N条件下在-78 ℃发生Ireland-Claisen重排,以91%的产率和3:2的dr选择性得到羧酸18,接着通过Barton的一锅法脱羧法得到关键中间体官能化环己烯20,产率为72%。
图源:Org. Lett.
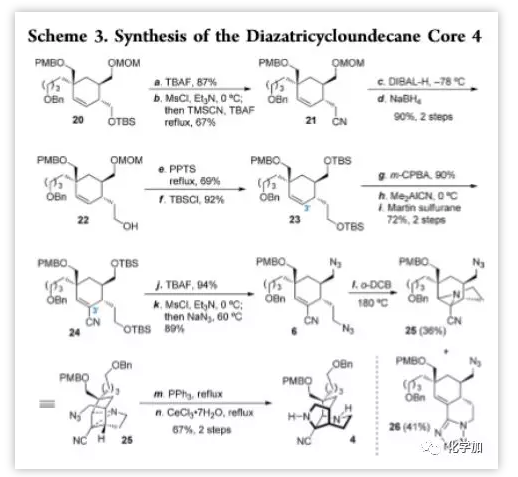
从20出发,作者开始构建(+)-Sarain A的二氮杂三环十一烷核心骨架(Scheme 3)。用TBAF脱除20的硅保护基,再通过甲磺酰化和亲核取代以总产率67%得到腈21,其通过DIBAL-H和NaBH4的连续还原得到醇22,两步收率为90%;再使用PPTS和TBSCl将22的MOM保护基转为TBS保护基得到23。23在m-CPBA作用下发生环氧化,收率为90%;再用Me2AlCN对环氧化物进行开环和取代,最后通过Martin试剂脱水得到烯基腈24,两步总产率为72%。用TBAF处理24脱去硅保护基,再通过甲磺酰化和叠氮取代,以高收率得到关键中间体二叠氮化物6。在o-DCB中加热到180 ℃,6消去一分子氮气发生氮杂环丙烷化,以36%的产率得到25,同时有41%的四唑产物26生成。分离得到25后,用三苯基膦还原另一个叠氮基团得到伯胺,再在CeCl3催化下分子内亲核进攻打开氮杂三元环得到二氮杂三环十一烷4,两步总收率为67%。
图源:Org. Lett.
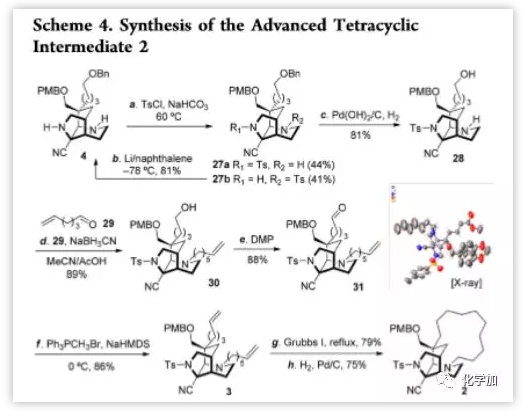
得到关键骨架4后,作者着手完成分子中的十三元大环(Scheme 4)。使用对甲苯磺酰氯处理4,可得到两种单保护产物27a(44%)和27b(41%),后者可通过Li/萘复原为4。27a通过温和的催化氢化脱去苄基保护基,以81%的产率得到醇28,其与醛29进行还原胺化得到氮上带端烯侧链的胺30,产率为89%。30的羟基通过DMP氧化和Wittig亚甲基化得到二烯3;3再在Grubbs I催化剂作用下进行RCM反应,产率为79%,最后以75%的产率氢化得到目标产物2.
图源:Org. Lett.
总结:秦勇教授课题组完成了(+)-Sarain A的核心骨架4的不对称合成,其关键步骤是通过叠氮化物构建氮杂环丙烷并进行分子内亲核开环得到二氮杂三环十一烷骨架。同时,通过Ireland-Claisen重排构建手性中心和RCM构建大环的步骤也可圈可点。该项研究或将为Sarain A一系天然产物的全合成提供新的思路。
撰稿人:吴强
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn