

由于有机电化学是利用电子作为无痕氧化还原试剂,因此这为有机合成提供了一种绿色可持续的工具。电化学可以通过单电子转移实现极性翻转,这导致具有相同极性的两个或多个官能团能够进行偶联反应。目前已有诸多烯烃与两个亲核试剂进行分子间阳极双官能化的报道(图 1a)。然而,大多数反应是向烯烃引入两个基于杂原子的官能团。
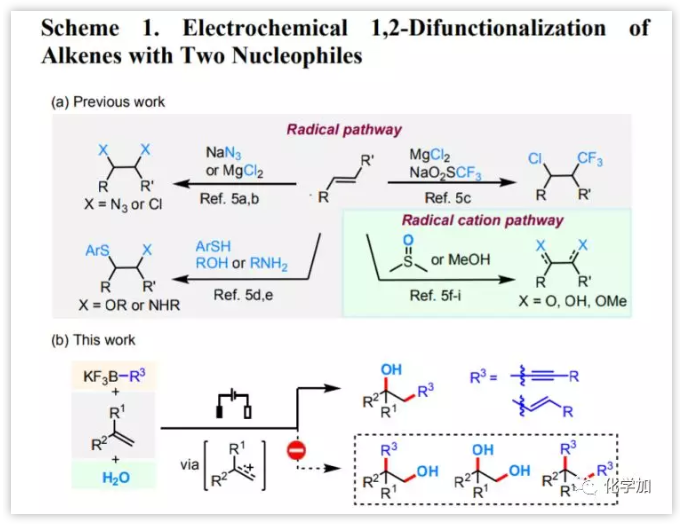
图1 烯烃的电化学1,2-双官能化(图片来源:J. Am. Chem. Soc.)
炔基三氟硼酸盐和烯基三氟硼酸盐因其廉价易得、稳定性好、结晶性良好而广泛应用于有机合成。目前,尽管没有炔基三氟硼酸盐与自由基物种反应的相关报道,但烯基三氟硼酸盐可以与亲电自由基和烯胺衍生的自由基阳离子发生区域选择性反应。在上述研究的鼓励下,近日,厦门大学徐海超教授课题组经烯烃双键连续与炔基或烯基三氟硼酸盐和H2O的加成实现了电化学促进的烯烃区域和化学选择性的羟基炔基化和烯烃化反应(图1b)。
作者首先通过优化烯烃1与H2O和炔基三氟硼酸盐2双官能化的反应条件开始进行研究(图2)。在配备有石墨棒阳极和铂板阴极的无隔膜电解槽中以含有添加剂KHCO3的MeCN/H2O为混合溶剂,50 ℃恒定电流5 mA下进行电解,反应效果最佳,以78%的收率获得单一区域异构体的异丙炔醇产物3。 对照实验表明,反应在室温(entry 2)或无KHCO3(entry 3)时效率降低,并且在没有电流时,反应停止(entry 4)。

图2 条件筛选(图片来源:J. Am. Chem. Soc.)
然后作者首先通过改变烯烃的取代基来研究反应的底物范围(图3)。当以1,1-二苯基烯烃1为底物时,该反应与苯环上的各种取代基都能相容(4-13)。芳基或烷基取代的烯烃(14-24)也具有良好的耐受性。此外,连有杂芳基取代基的烯烃,如3-吡啶基(25),2-噻唑基(26),2-苯并噻唑基(27)或2-苯并噁唑基(28),均为合适的底物。然而,当使用单取代的苯乙烯基烯烃时,产物的收率显著降低(29,30)。二取代的芳基烯如1-丁烯-1-基苯可以顺利得到目标产物31,收率55%,尽管其非对映选择性较低(dr值为1.3:1)。而三取代烯烃1,1-二苯基丙烯的反应能以27%和51%的收率得到羟基炔化产物32和邻二醇33。该烯烃优先与H2O反应,可能是由于空间位阻的需求增加所致。
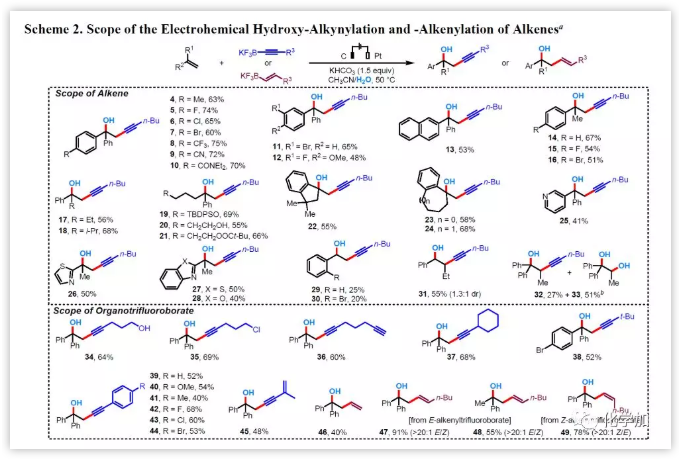
图3 底物拓展(图片来源:J. Am. Chem. Soc.)
接下来,作者考察了多种有机三氟硼酸钾的适用范围(图3)。2中末端丁基部分可由含有羟基(34)、氯(35)或炔基(36)、空间位阻较大的环己基(37)或叔丁基(38)或对位取代的H(39)、甲氧基(40)、甲基 (41)或卤素(42-44)的苯基环和烯基(45)代替。令人高兴的是,烯基三氟硼酸盐也适用于该反应体系,并以中等至极好产率得到高烯丙醇(46-49)。重要的是,烯基三氟硼酸盐的立体化学在反应过程中保持一致(47-49)。
进一步的研究发现(图4),电化学烯烃二官能化反应与其他杂原子亲核试剂如甲醇(50)、酰胺羰基(51-67)或羟基(68-69),甚至氟化物(70)相容,并能以良好的收率得到目标产物。
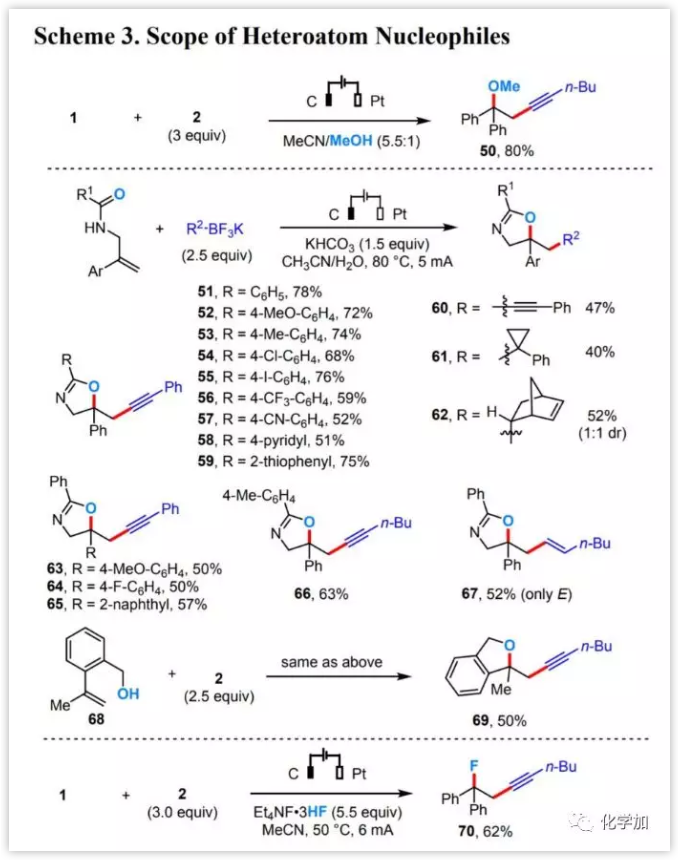
图4 底物拓展(图片来源:J. Am. Chem. Soc.)
随后,作者提出了该电化学双官能化反应的可能机理(图5)。反应开始于烯烃A的阳极氧化[Ep/2 (1)=1.57V vs SCE]产生自由基阳离子B,它被有机三氟硼酸盐试剂C捕获[Ep/2 (2)=2.06 V vs SCE],形成碳中心自由基D。D经阳极氧化形成碳阳离子E,然后它与H2O反应得到最终的醇产物F。在阴极,H2O被还原成H2和HO−。后者被F和添加剂碳酸氢盐生成的H+所消耗,从而阻止了HO−的累积。
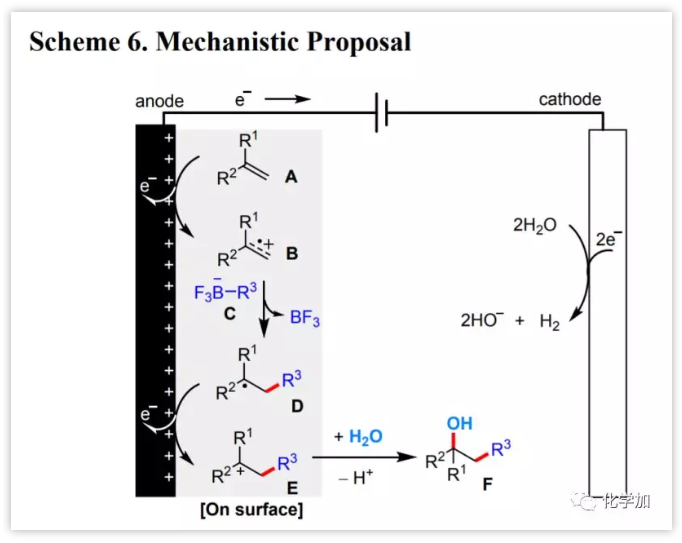
图5 反应机理(图片来源:J. Am. Chem. Soc.)
总结:徐海超课题组利用两个容易获得且稳定的亲核试剂实现了芳基烯烃的首例区域和化学选择性羟基炔基化和羟基烯基化反应。作者利用电化学促进烯烃的1,2-双官能化,该反应不仅无需过渡金属催化剂和氧化剂,还确保了所得高炔丙醇或高烯丙醇的高区域和化学选择性。
撰稿人:大白菜
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn