

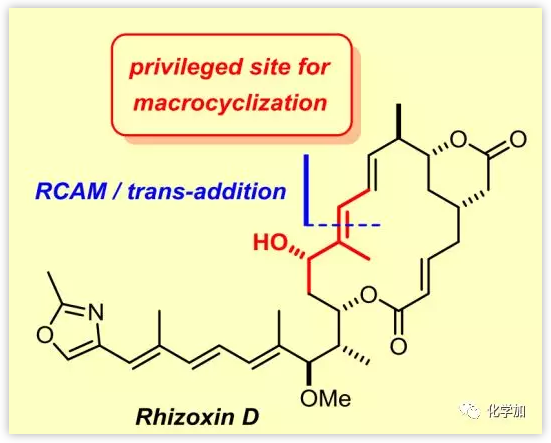
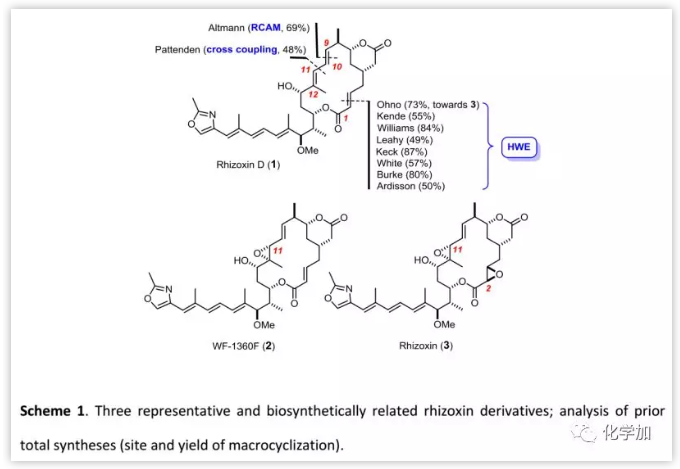
Rhizoxin(3)是从水稻病原真菌(Rhizopus chinensis)的培养基中分离得到的,属于Burkholderia菌属的细菌内共生体,还包括多种其他同源物如1和2,均具有抗真菌活性、显著的体外细胞毒性和体内抗肿瘤活性。不饱和变体rhizoxin D (1)可能是3的生物合成前体,也可以通过化学方法转化为2和3。由于1的生物活性与2和3的生物活性相似,该不饱和化合物在过去一直是全合成的焦点(Scheme 1)。大环内酯的合成区别主要体现在关环方式的不同,常用的关环方法包括通过HWE反应构建C2-C3烯醇键。目前,只有一篇基于分子内Stille交叉偶联构建1,3-二烯实现大环闭合的全合成报道。德国马克斯普朗克煤炭研究所Alois Fürstner课题组利用炔烃关环复分解反应完成了Rhizoxin D的全合成。
(图片来源:Angew. Chem. Int. Ed.)
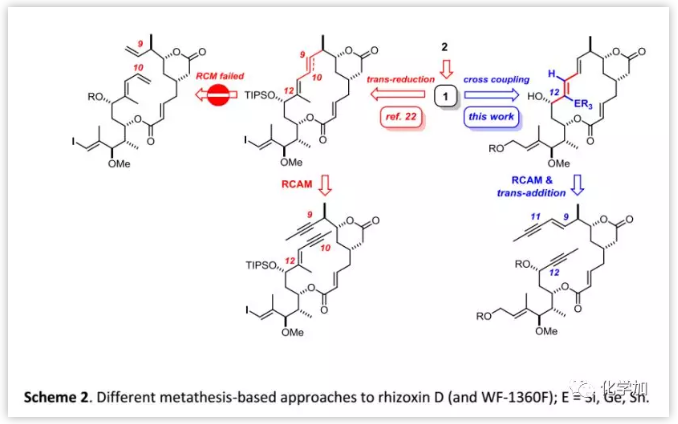
起初,有机化学家尝试通过闭环烯烃复分解反应(RCM)合成rhizoxins,但Altmann课题组曾报道利用RCM构建二取代C9-C10双键时未能实现闭环(Scheme 2)。与之相比,闭环炔烃复分解(RCAM)却可以很好地解决这个问题且收率高达69%。然而,大位阻环境使得炔烃被还原为E-烯烃;另一种间接的方法是通过与相应的Co2[CO]6络合物构建出Z-烯烃,然后经还原解离、自由基异构化得到E-异构体。
(图片来源:Angew. Chem. Int. Ed.)
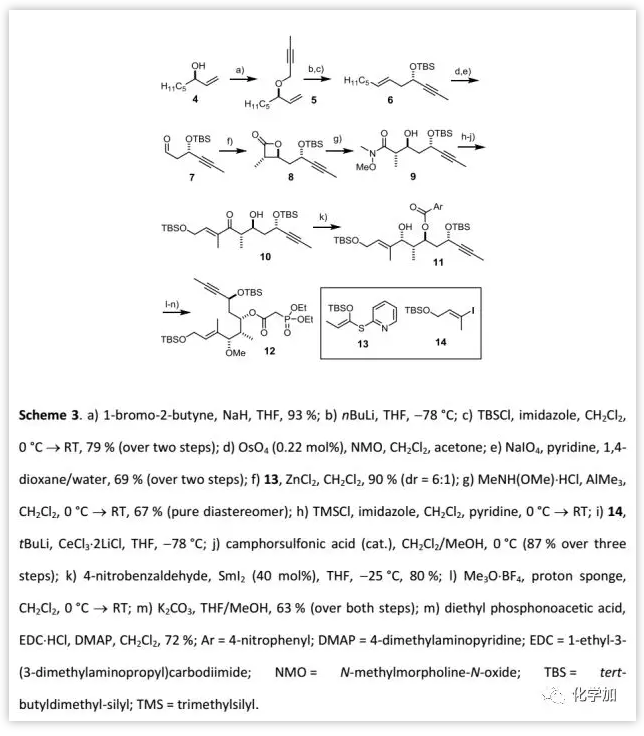
片段12的制备(Scheme 3):
首先,作者以醇4衍生得到的烯丙基炔丙醚5进行[2,3]-Wittig重排得到烯炔6,经双键断裂氧化得到醛7,然后与混合烯酮缩醛13进行Mukaiyama-型羟醛缩合反应/内酯化得到相应的β-内酯8,经Weinreb反应开环得到Weinreb酰胺9。随后,将9进行TMS保护后,与14 偶联得到羟基酮10,其羟基经对硝基苯甲酯保护后,进行Evans-Tishchenko氧化还原酯化引入反式-1,3-二醇片段。最后,对11中的羟基进行甲基化,然后将对硝基苯甲酯交换磷酸乙酯得到化合物12。
(图片来源:Angew. Chem. Int. Ed.)
片段22的制备及与片段12的连接(Scheme 4):
作者以巴豆醇15为原料,经Sharpless环氧化、开环得到二醇17(≥10:1),然后转化为末端环氧化物18后,进行格氏反应得到19,其双键经环氧化、水解产生的双羟基用丙酮叉保护,选择性还原炔丙基、去缩酮保护后得到二醇21,再选择性氧化半缩醛得到相当不稳定的醛22。最后,通过HWE反应将22与磷酸酯12连接得到环化前体23。
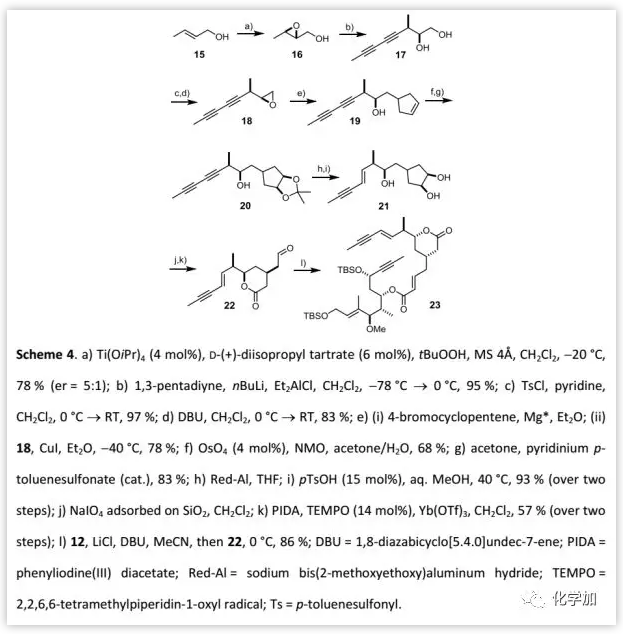
(图片来源:Angew. Chem. Int. Ed.)
Rhizoxin D的全合成(Scheme 5):
在得到二炔23后,作者利用[Mo(N(t-Bu)Ar)3] (30)/CH2Cl2催化体系实现RCAM并以67-70%的收率得到关环产物24。随后,作者脱去23中的两个TBS保护基得到二醇25在催化剂31作用下进行RCAM,得到大环产物26(两步50%)。接下来,作者对26进行关键的炔基选择性锡氢化反应得到锡烷27,并利用MeI/CuTC/[Ph2PO2][NBu4] 或[(cod)Pd(Cl)(Me)]条件进行C-甲基化得到三取代烯烃28作为单一的区域和立体异构体。然后,按照Pattenden课题组报道的方法将其转化为29,并最终完成rhizoxin D (1)的全合成。
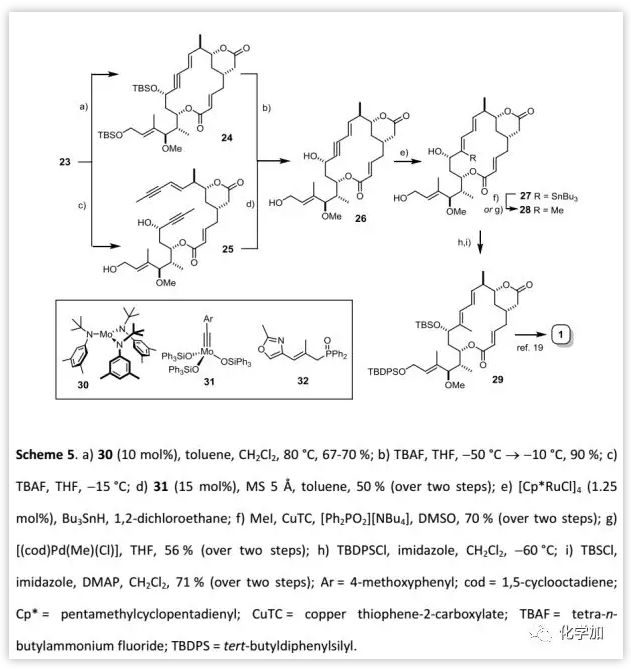
(图片来源:Angew. Chem. Int. Ed.)
利用炔基选择性锡氢化反应,还可以灵活地引入各种(三取代)烯烃和相关片段(Scheme 6):除文章涉及的C外,还包括其他很多天然产物,特别是聚酮类天然产物中遇到的亚结构片段如D、E或G等。因此,作者开发的合成策略可以用于大量(生物活性)目标化合物的合成,可能具有更广泛的相关性。
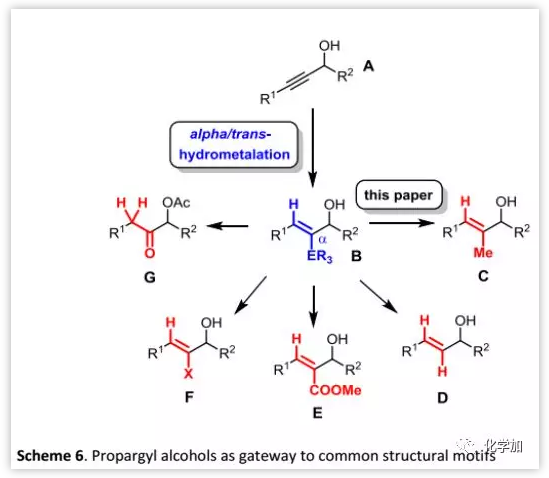
(图片来源:Angew. Chem. Int. Ed.)
小结:Alois Fürstner课题组利用炔烃关环复分解反应完成了rhizoxin D的全合成。作者开发的关环方法不同于以往的方法即大环化合物必须在二取代的烯烃位点关环,而是以邻位为烯丙羟基的三取代C11-C12烯烃作为合成的支点,然后通过一系列炔烃复分解、反式氢化和交叉偶联得到相应的产物。由于与此完全相同的亚结构(邻位为烯丙羟基的三取代烯烃)广泛存在于许多天然产物中,因此,作者开发的关环策略意义重大,具有更广泛的应用前景。
撰稿人:爽爽的朝阳
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn