


通过消旋的烷基亲电试剂和碳亲核试剂的对映选择性取代反应生成碳碳键的方法已经得到长足发展,但其亲电试剂底物结构中往往需要有导向基(A)或具有临近离去基团的p/π轨道(B)的存在(Figure 1)。
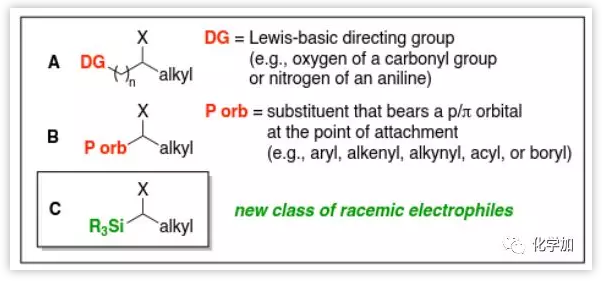
Figure 1.背景:消旋亲电试剂用于不对称交叉偶联反应
图片来源:Angew. Chem. Int. Ed.
近日,来自加州理工学院的Gregory C. Fu课题组报道了以α-卤代硅烷C作为亲电试剂的对映选择性碳碳键偶联生成具有手性的有机硅烷,成功将此类反应的底物扩展到上述两种结构A和B以外的范围(DOI:10.1002/anie.201814208)。在药物分子中引入硅元素后可提高药理学性质,且不具有元素特有的毒性。本文工作成功实现了在手性镍催化下,将消旋的α-卤代硅烷和烷基锌试剂进行不对称交叉偶联生成具有手性的有机硅烷,条件温和简单[Eq. (1)]。也证明了此类交叉偶联反应并不局限于A和B两种底物类型(Figure 1)。
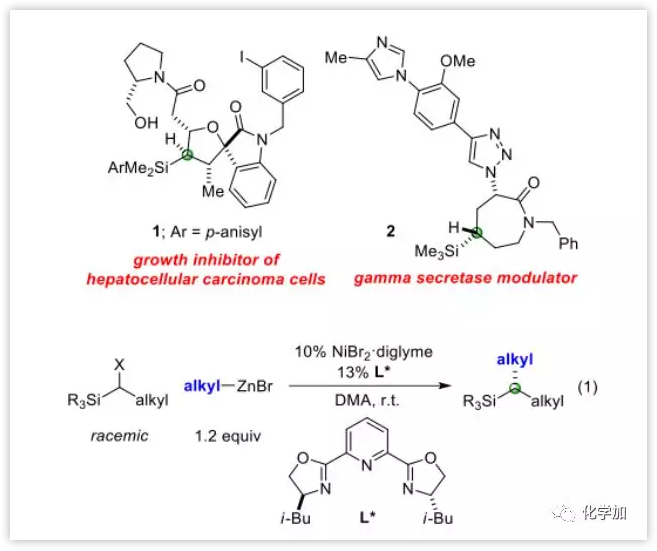
图片来源:Angew. Chem. Int. Ed.
作者采用NiBr2⋅二甘醇二甲醚和手性双噁唑啉配体 (L*)以78%的产率和92%的ee值成功实现了此不对称偶联反应(entry 1)。然后进行条件筛选:在没有Ni催化剂条件下并未观察到偶联产物生成(entry 2);在没有配体L*条件下产率偶联极低(entry 3)。在有水和空气条件下虽然对反应的ee值影响不大,但产率受到较大影响(entries 4 and 5)。尝试了其他不同配体,效果均不及L* (entries 6–9),尽管把离去基团换成碘也可得到较好的产率和ee值,但当离去基团是氯的时候,偶联反应不能进行 (entry 10和11)。当降低催化剂载量时偶联产率降低,ee值却没有变化(entry 12)。
Table 1.反应参数影响
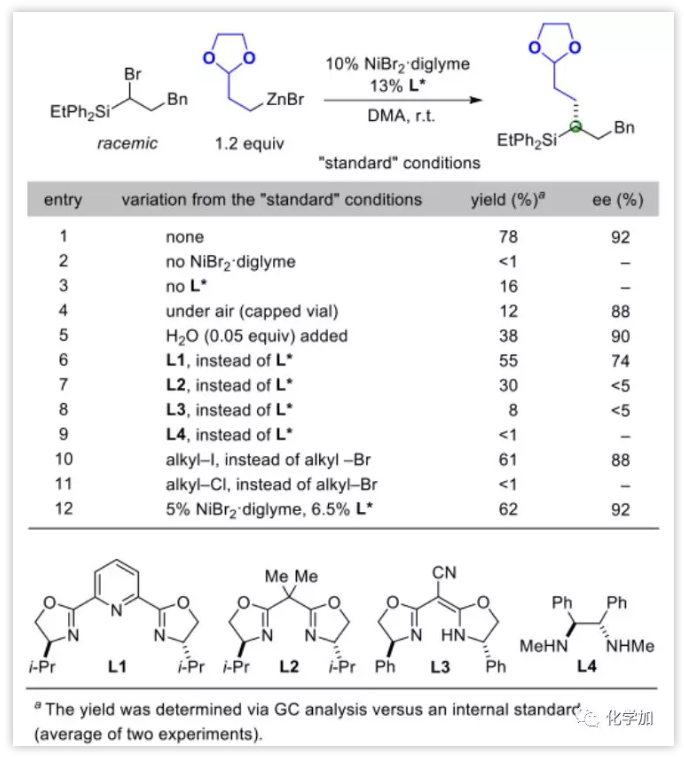
图片来源:Angew. Chem. Int. Ed.
接下来作者研究了一下含不同取代基的α-溴硅烷亲电试剂底物范围(Table 2),发现含有烯烃、醚、芳基氯、饱和以及不饱和的氧、含氮杂环基团的底物参与反应时候ee值均未受很大影响。尽管亲电试剂α-位置有取代基会影响偶联反应,β-位的取代基却可以很好兼容(entries 7–9)。在硅上引入一系列取代基后发现,随着亲电试剂的空间位阻的增加,产率也随之下降(entries 11–14)。
Table 2. 亲电试剂底物范围拓展
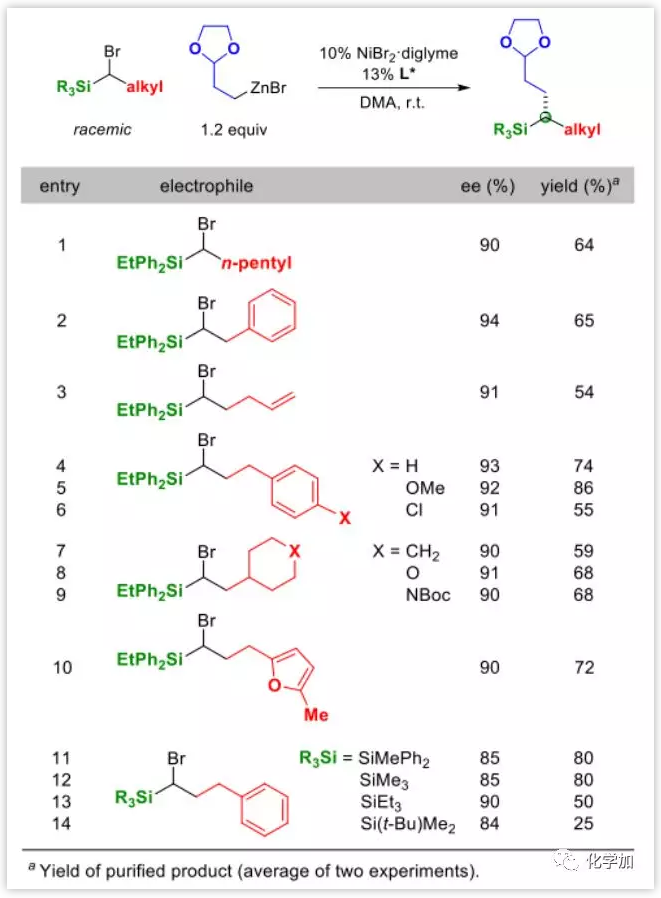
图片来源:Angew. Chem. Int. Ed.
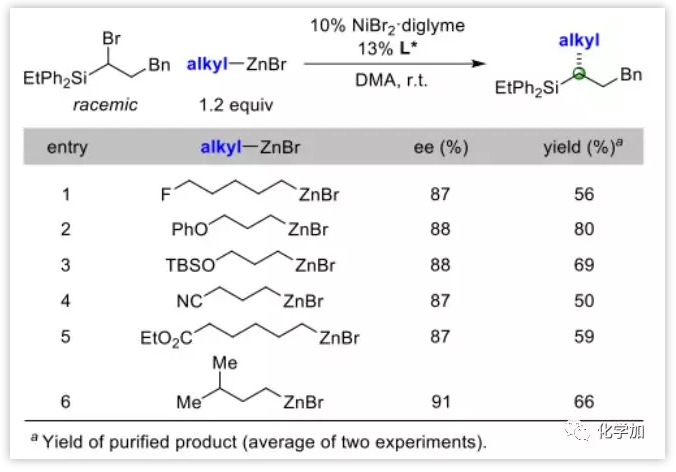
然后作者又拓展了一下锌试剂范围,发现其可兼容烷基氟、醚、氰基和酯基团 (Table 3中的entries 1–5)。偶联反应对支链的兼容性不够,在α-和β-位的反应不好,但对γ-位的支链却可兼容。将entry 2 中反应放大到克级规模,产率和ee值都尚可。
Table 3. 亲核试剂的底物范围拓展
图片来源:Angew. Chem. Int. Ed.
作者认为此反应类似于镍手性双噁唑啉催化的不对称Nigishi 炔丙基卤反应,络合物C作为非活性主要成分在体系中大量聚集,浓度远大于A,B和D。通过ESI–MS 分析和EPR谱图也证实了这个观点。
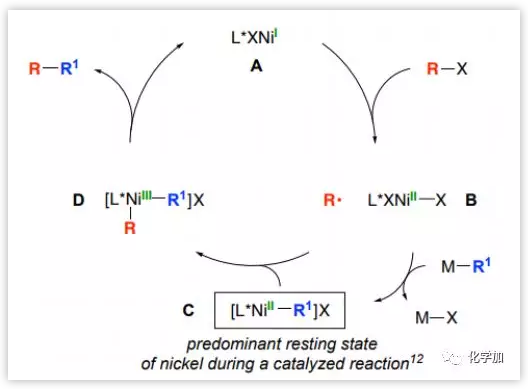
Figure 2. 可能的反应机理图
图片来源:Angew. Chem. Int. Ed.
作者最后简单研究了下机理,标准条件下α-溴硅烷底物并没有消旋,说明碳-溴键的切断是不可逆[Eq. (2)],且消旋的亲电试剂不对称偶联反应中,手性催化剂对于亲电试剂并无手性选择性,说明此过程并非动态动力学拆分。当把此不对称偶联反应在中途停止,发现剩余的亲电试剂底物仍旧是消旋状态,说明此过程也不是动力学拆分。
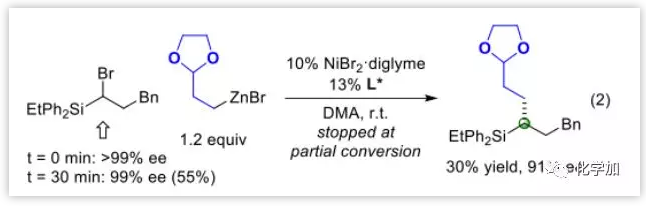
图片来源:Angew. Chem. Int. Ed.
结语:作者将此类反应的底物扩展到含导向基、临近p/π轨道的之外的范围,很大程度上增强了反应的适应性,使得可以在很简单温和的条件下实现手性有机硅烷的合成。机理研究表明此反应并非动力学拆分。
撰稿人:暗夜卡宾
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn