

(图片来源:Angew. Chem. Int. Ed.)
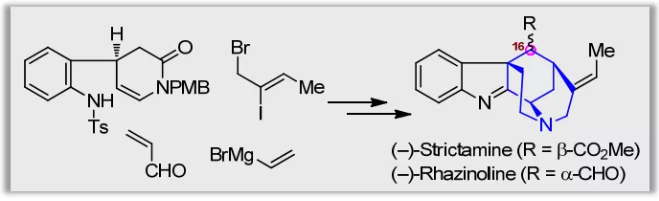
灯台生物碱(Akuammiline alkaloid)是一类具有广泛生物活性的单萜吲哚生物碱,主要存在于夹竹桃科( Apocynaceae) 植物中。其中,Aspidophylline A,Aalophyline A,Picrinine,Scholarisine A,Strictamine以及Vincorine作为灯台生物碱家族的代表分子,以其复杂多样的结构和显著的生理活性一直受到合成化学家广泛关注。
Strictamine类生物碱(1-3,Scheme 1A)属于灯台生物碱中一个重要的亚型。在结构上,它们具有一个笼状的methanoquinolizidine核心骨架和4个手性中心,还包括C16位多样化的取代基及空间构型,因而具有较高的合成难度。
2016年,Garg小组利用Fischer 吲哚合成策略首次实现了Strictamine的不对称全合成。同年,祝介平课题组也完成了(±)-Strictamine的全合成工作(Angew. Chem. Int. Ed. 2016, 55, 3500.),尽管最终由镍催化的还原Heck环化反应构建E环的关键反应收率较低,其所报道的中间体仍被Fujii/Ohno(Org. Lett. 2016, 18, 1670.)、Gaich(Chem. Commun. 2016, 52, 11363.; Chem. Eur. J. 2017, 23, 3938.)、Snyder(Org. Lett. 2017, 19, 1004.)、秦勇(Chem. Commun. 2017, 53, 12665.)等多个课题组在随后针对Strictamine的形式合成中所采用。
在前期工作中,秦勇教授课题组发展了三种类型的光催化的自由基串联反应(Chem, 2017, 2, 803.),用以高效构建三种单萜吲哚生物碱的基本骨架,包括:白坚木型(Aspidosperma, type I)、四氢咔波啉型(tetrahydrocarbolinone, type II)以及柯楠因型(Corynanthe, type III)。基于此,作者拟采用type II光催化的自由基串联策略完成 (–)-Strictamine及(-)-Rhazinoline核心骨架的构建(Scheme 1B)。
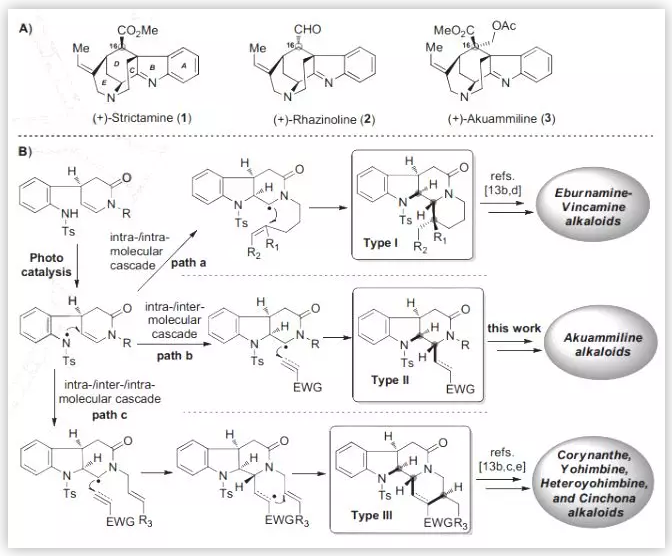
图1. Strictamine类生物碱及秦勇课题组发展的光催化的自由基串联反应
(图片来源:Angew. Chem. Int. Ed.)
随后,作者对目标分子进行了逆合成分析(Scheme 2)。考虑到当在C环存在下,E环的构建需要克服较高的能垒,因此,C环将通过化合物4的分子内的N-烷基化反应在最后构建。而E环则先于C环通过烯基碘与双键的环化反应构建。D环的构建则主要通过格氏反应在醛类中间体10上引入乙烯基后,再通过分子内的Tsuji-Trost 烯丙基化反应来完成。而(–)-Strictamine及(–)-Rhazinoline 核心骨架三环内酰胺主要经由type II型光催化的自由基串联策略构筑。
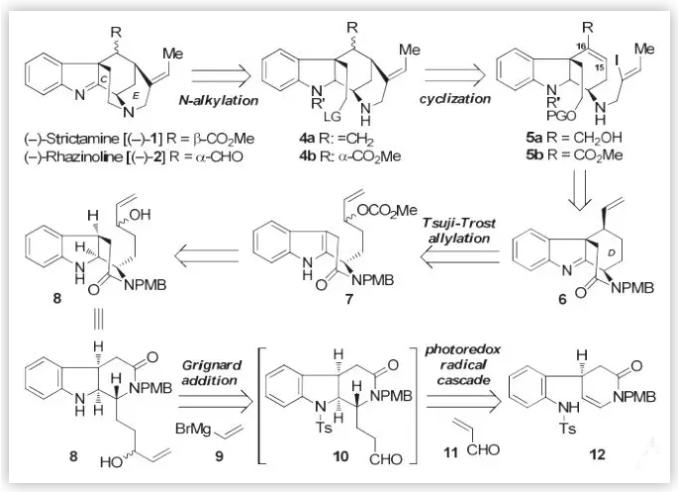
图2. (–)-Strictamine及(–)-Rhazinoline的逆合成分析
(图片来源:Angew. Chem. Int. Ed.)
基于上述逆合成分析,作者从简单易得的手性醛酯13出发(Scheme 3),与对甲氧基苯胺反应以68%的收率得到烯胺化合物14,随后对硝基进行还原、保护得到化合物12(两步69%)。接下来,化合物12在Ir(dtbbpy)(ppy)2PF6的催化下,与丙烯醛发生分子间/分子内的串联反应,随后与烯基溴化镁加成,再通过钠/萘脱除Ts保护,“一锅法”得到了一对三环内酰胺化合物8的非对映异构体(d.r. 1.15:1,47%)。随后,作者在氧气的作用下并使用氯甲酸甲酯将化合物8转化为碳酸酯类化合物7,再通过Tsuji-Trost 反应合成了四环内酰胺14(74%)。考虑到C环对E环构筑的影响,作者通过水解酰胺键打开C环,同时得到了内酯化合物15(70%)。接下来,作者对化合物15进行了还原以及选择性地保护,得到三环中间体16。
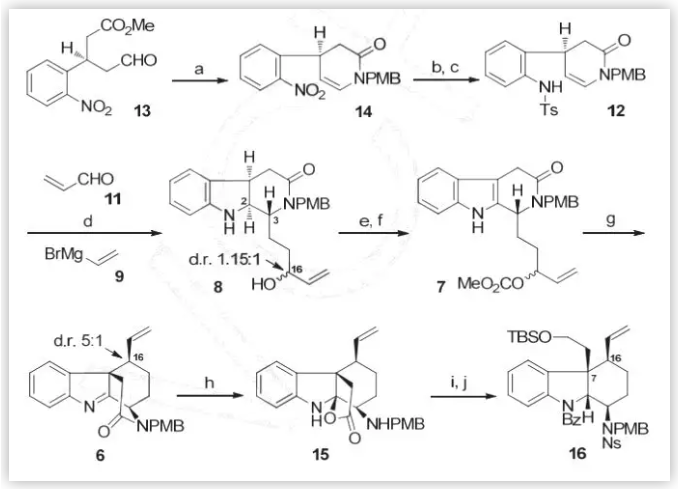
图3. 三环中间体16的合成路线
(图片来源:Angew. Chem. Int. Ed.)
在得到三环中间体16后,作者随后在N4位引入合适的侧链来进一步完成E环的构建(Scheme 4)。首先,通过OsO4/NaIO4氧化、α-位硒化消除得到烯醛化合物17,在此基础上利用Pinnick氧化、TMSCHN2作为甲基化试剂,以两步84%的收率将烯醛化合物17转化为酯类化合物18。针对TBS保护基对后续反应条件的耐受性较差,作者将TBS更换为特戊酰基(95%),并将N4位的PMB及Ns保护基脱除,随后与溴化物21反应成功的在N4位引入含有烯基碘的侧链。接下来,通过还原Heck环化反应完成了E环的构建,并对仲胺进行Boc保护(两步48%)。最后,作者对末端羟基脱除Piv保护并甲磺酰化,使用PCC将二氢吲哚氧化为亚胺,通过TFA脱除Boc保护的同时完成分子内的N-烷基化(两步41%),再对C16位的酯基进行DIBAL-H还原、Swern氧化(两步68%),成功的完成了(–)-Rhazinoline 的合成。
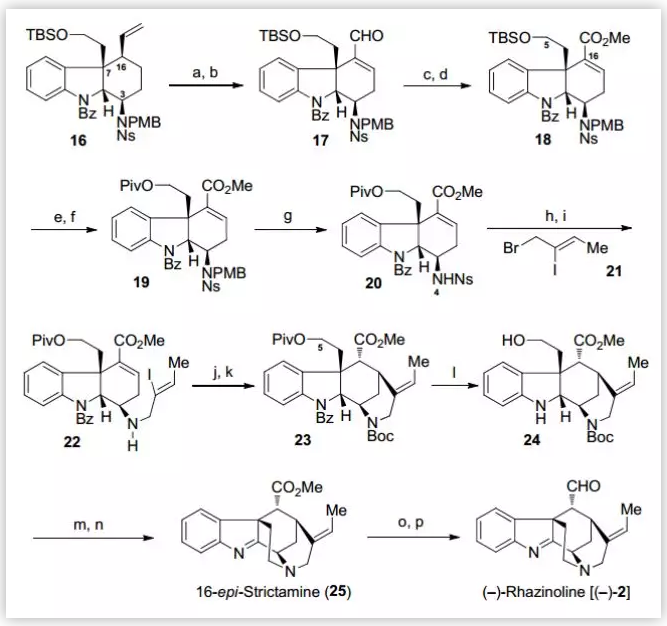
图4. (–)-Rhazinoline 的全合成
(图片来源:Angew. Chem. Int. Ed.)
为了使C16的基团差向异构化,进而完成(–)-Strictamine的合成,作者从三环醛类中间体17出发(Scheme 5),通过Luche还原、脱保护得到二醇化合物16,随后使用上述类似的方法在N4位引入含有烯基碘的侧链,并通过Ni介导的还原Heck环化反应完成E环构建的同时,在C16位引入了末端双键。接下来,作者利用分子内的N-烷基化反应,以高达95%的收率,完成了C环的构建,并通过硼氢化氧化顺利的得到了单一的非对映异构体31(54%)。最后,通过连续的氧化、酯化反应实现了(–)-Strictamine的全合成。
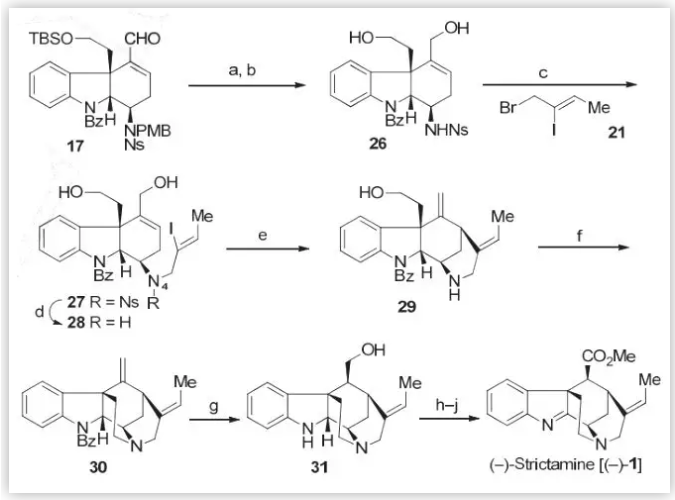
图5 . (–)-Strictamine 的全合成
(图片来源:Angew. Chem. Int. Ed.)
总结:四川大学华西药学院的秦勇教授团队借助光催化的自由基串联反应以及过渡金属催化的环化反应为关键步骤,实现了(–)-Strictamine 及 (–)-Rhazinoline 的不对称全合成。其关键步骤主要包括:type II型光催化的自由基串联策略对手性四氢咔波啉核心骨架的构建,以及Tsuji-Trost烯丙基化反应、钯或镍介导的还原Heck环化反应、分子内的N-烷基化反应对目标分子中D、E、C环的顺序构建。这种独特的合成策略对含有methanoquinolizidine核心骨架的灯台类生物碱具有重要的意义。
撰稿人:L-脯氨酸
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn