

仿生合成、多样性发散合成以及化学合成与合成生物学的协同结合策略在天然产物的全合成中越来越被广泛重视。特别是以自然界含量丰富的可再生资源或者易得的简单化合物为原料将绿色环保的原子经济学合成理念以及高效高立体选择性串联反应的新颖设计应用到天然产物理想全合成中更具有实际应用价值。呋喃及其衍生物是自然界中广泛存在的一种可再生的廉价原料,已经被成功运用于高分子聚合材料与各种有机反应之中,其中一类著名的反应便是Achmatowicz重排反应。
Achmatowicz 重排是由波兰化学家Osman Achmatowicz Jr.在1971年开发的反应,在温和的氧化条件下可以很方便地将呋喃醇转变为二氢吡喃六元环,进而进行更多后续的衍生如糖基化、环加成、Michael加成等转化成为更有价值的复杂结构。
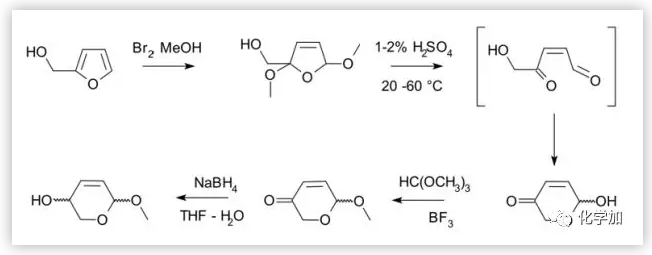
图1. Achmatowicz rearrangement反应示例
由于该反应高效简洁,多年来被广泛应用于化学合成中。The University of Texas的Stephen F. Martin课题组、南方科大的李闯创课题组以及香港科大的童荣标课题组等均在将Achmatowicz重排反应用于天然产物全合成方面做了很多漂亮的工作。Aza-Achmatowicz反应是Achmatowicz反应的一个衍生,其反应底物是呋喃胺类化合物,经过氧化重排后产生哌啶类衍生物,这一类含氮结构在很多天然产物特别是具有生物活性的生物碱和药物分子中占据着核心骨架的位置。在本篇文章中,作者针对该Aza-Achmatowicz反应产物,利用吲哚的亲核加成高效选择性特点,实现了含有吲哚并环的[3.3.1]环的构筑,并对其进行了条件的优化以及底物拓展,随后将其应用到全合成中,实现了(-)-Alstofolinine A的首次全合成。
齐湘兵课题组对以自然界丰富的可再生资源或廉价原料为底物来开发高效合成方法进而应用到复杂天然产物,特别是吲哚类生物碱的理想全合成上有着浓厚的兴趣。基于呋喃及其衍生物是应用非常广泛的生物质来源的原料,便宜易得并且结合Aza-Achmatowicz反应的巨大可衍生潜力,他们设想能否将其应用到吲哚类天然产物的全合成之中,并由此提出了一系列高效串联反应的设想。如图2所示,如果吲哚与呋喃分别构建在氮原子的两侧,如化合物1,那么经过Aza-Achmatowicz反应就可能会形成中间体Ts-1,由于这个中间体有着易被进攻的亚胺结构,那么具有亲核性的吲哚2-位就有可能对这个位点进攻,从而产生四环化合物2。化合物2是一系列吲哚类天然产物的重要结构骨架,如Pleiocarpamine等;如果吲哚和胺基分别通过碳链取代在呋喃的同侧2-和3-位,如化合物3,那么经过Aza-Achmatowicz反应就可能会形成中间体Ts-2,这时吲哚的2-位对这个位点进攻就有可能形成化合物4。对化合物4进一步转化就会合成天然产物Aspidophylline的骨架;另外一种情况是呋喃、烷基胺和吲哚三个官能团被同一个碳连接,如化合物5所示。经过Aza-Achmatowicz反应就可能会形成中间体Ts-3,同样,若吲哚的2-位对亚胺进攻形成新的六元环后,就会形成一个包含吲哚[3.3.1]四环体系6。化合物6是一系列天然产物如Macroline/Sarpagine/Ajmaline生物碱的共同中间体,所以一旦完成这类转化,后面可以实现一大类天然产物的多样性合成。值得一提的是Scheme 1 里面的设计仅仅是基于简单的色胺类底物(烷基取代在吲哚C3位)发生串联反应的部分例子,其他类型的排列组合也会产生更多样的吲哚类多环体系。(详见supporting information)
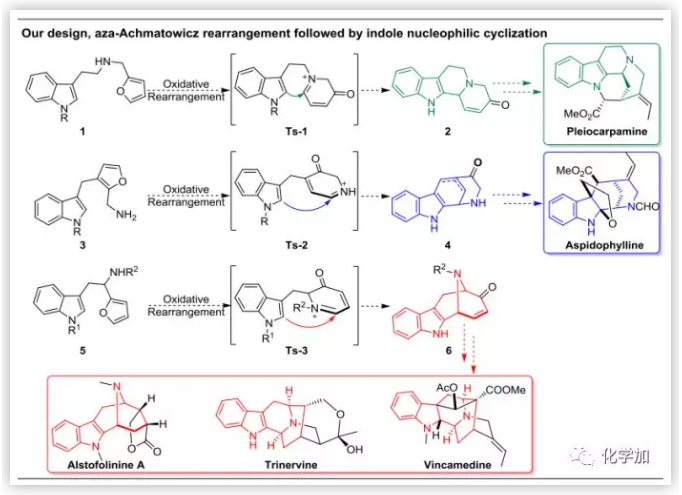
图2. 含有吲哚并环的多环骨架的构建方法(图片来源:Angew. Chem. Int. Ed.)
齐湘兵课题组先对以化合物5为起始原料的第三条路线进行了探索,合成吲哚[3.3.1]环骨架结构。上个世纪Cook等人就已经开发了构筑该环的方式:从色氨酸出发,经历Pictet-Spengler环化、Dieckman缩合、脱羧等反应。目前为止Cook课题组已经很漂亮地完成了几十种基于这类骨架的生物碱全合成,本文作者开发的方法使用呋喃、吲哚衍生物,原料廉价易得,而且反应更加高效简洁,立体选择性专一,这些优点使这一串联反应的应用会更广泛地延伸到Macroline/Sarpagine/Ajmaline等生物碱的全合成中。
作者针对该反应进行了仔细的研究,首先研究了保护基对该反应的影响,在m-CPBA氧化条件下,如果不对氨基、吲哚氮进行保护(保护基R1,R2),无法得到目标产物,得到的是另一种产物7-1(图3),如果仅仅对吲哚氮使用Boc保护,同样无法得到目标化合物6,得到另一种产物7-2,只有在m-CPBA氧化时对两个氮分别使用Boc、CF3CO同时保护,随后在硅胶甲苯回流的条件下脱除吲哚的保护基,才能够得到最终的目标化合物6,而且产率仅有5%。
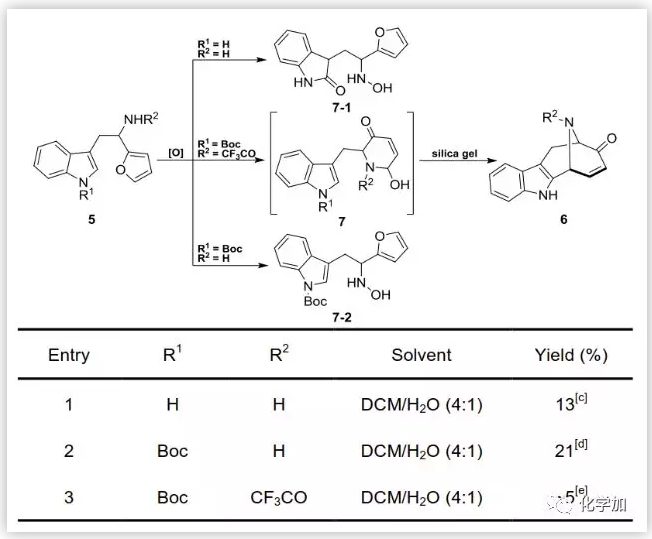
图3. 保护基对于氧化反应的影响(图片来源:Angew. Chem. Int. Ed.)
作者随后对反应条件进行了优化(图4):首先尝试氨基的不同保护基(R2),Acetyl(Yield,29%)效果明显劣于Ts(Yield,47%)。增加体系的酸性并没有提高产率(entry 3),对不同的氧化剂进行考察,发现Oxone, H2O2, TBHP不适合该反应体系(Entries 4-6),但是NBS却有更好的效果(entry7)。随后改变了溶剂的比例,最终筛选到了最优条件NBS 1.2 eq.,MeCN/H2O=4:1,(80%,entry13)。
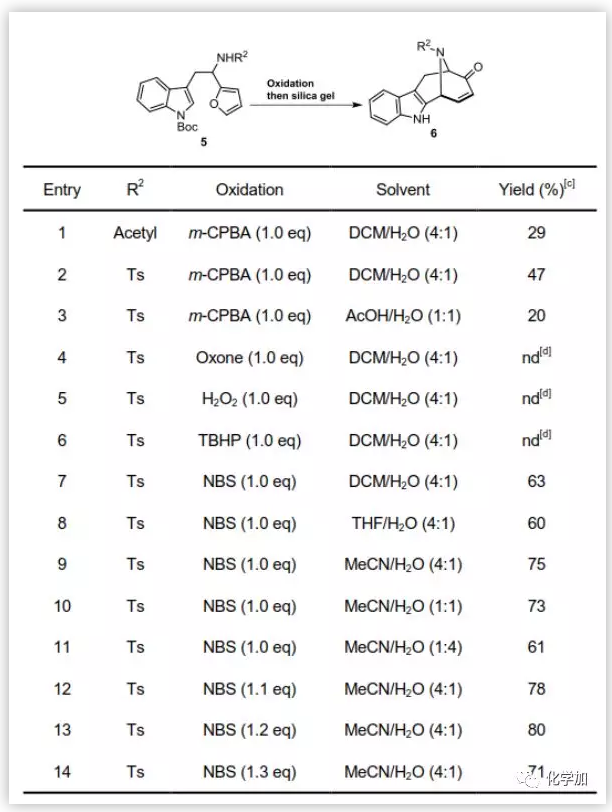
图4. 反应条件的优化(图片来源:Angew. Chem. Int. Ed.)
在此条件下,作者随后进行了底物的拓展(图5):改变吲哚苯环上的取代基及位置(R1),胺上的取代基类型(R2)以及呋喃环上的取代基(R3),发现该反应具有良好的官能团耐受性,更重要的是,还可以利用该反应构建[4.3.1]、[5.3.1]大环,仍有不错的产率(6p、6q)。
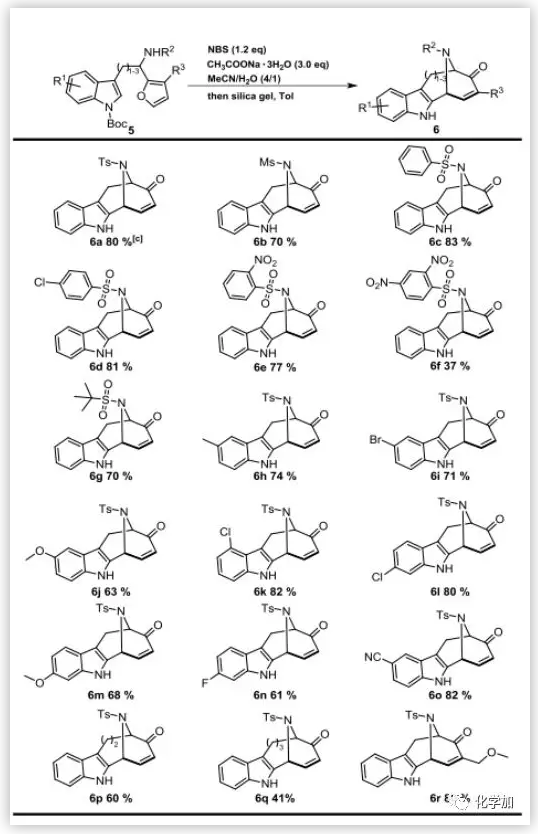
图5. 底物扩展(图片来源:Angew. Chem. Int. Ed.)
随后,作者利用该反应进行了植物来源的天然产物(-)-Alstofolinine A首次全合成的尝试(图6)。其全合成可以分为基本骨架的构筑(8-6g)以及后续修饰(6g-final product)两大部分。作者首先使用Ellman's sulfinamide作为手性控制试剂,合成了手性化合物9,随后m-CPBA氧化获得化合物5g,接下来使用优化的条件,得到了其基本骨架化合物6g。基本骨架构筑完成后就是后面的官能团修饰过程,首先进行吲哚N的甲基化,合成化合物10,然后利用碳酸二甲酯与phNTf2将10转化成化合物11,然后利用Stille交叉偶联得到化合物12,Pd/C氢化后,最后进行磺酰基R的脱除。最开始作者使用TfOH或 TFA会使化合物13降解,最终作者发现使用过量的AlCl3可以将R基团顺利脱除,最终成功合成了(-)-Alstofolinine A,其核磁数据和旋光数据都和已报道的数据一致。在完成全合成的基础上作者又对该方法合成的所有关键复杂中间体和最终产物进行了详细的针对四种不同癌细胞的毒性试验(结果见SI),发现其中七个化合物对四种不同的癌细胞系表现出高选择性的特异细胞毒性,这一结果为药物先导分子发现和后续的构效关系优化提供了新颖的骨架结构和有用的核心构效信息。
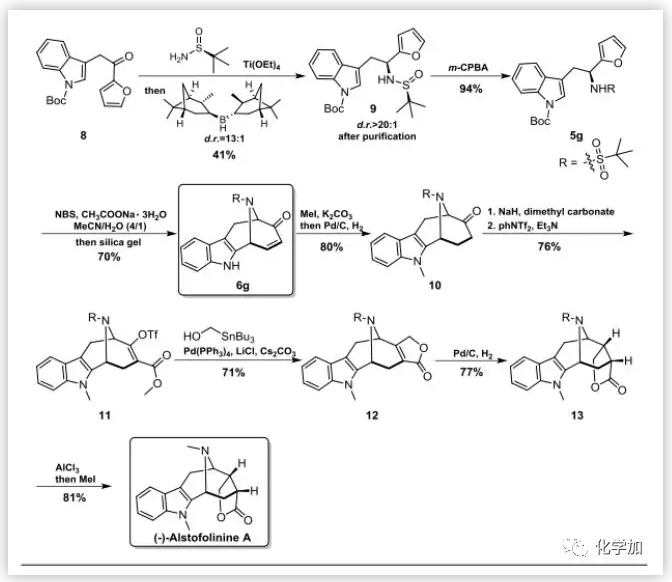
图6. (-)-Alstofolinine A(图片来源:Angew. Chem. Int. Ed.)
小结:北京生命科学研究所齐湘兵课题组利用呋喃、吲哚衍生物等廉价易得原料为底物,利用Aza-Achmatowicz反应及吲哚亲核环化,实现了其中一类吲哚 [3.3.1]环的高效构筑,验证了保护基对该反应的影响,优化了反应条件,并扩展了底物,最终应用该反应实现了天然产物(-)-Alstofolinine首例全合成。这种方法不仅可以应用到其他Alstofolinine类似物的合成上,还可以扩展到更复杂的吲哚生物碱的全合成中。
课题组简介:齐湘兵博士自2005年在美国德州大学西南医学中心(UT Southwestern Medical Center)生物化学系Joseph Ready实验室攻读博士学位,2009年获得有机化学/生物化学博士学位后分别在伊利诺伊大学厄巴纳-香槟分校(UIUC)化学系与德州大学西南医学中心生物化学系进行博士后研究和药物开发工作。出国前在上海有机所工作,师从马大为教授从事药物开发和全合成研究,回国后担任北京生命科学研究所化学中心主任一职,负责小分子高通量筛选,药物开发以及有机合成研究。同时于2018年起受聘清华大学生物医学交叉研究院研究员。齐湘兵实验室主要从事天然产物全合成、有机合成方法学、药物化学特别是新靶点的药物开发(First in Class)。基于细胞水平的高通量小分子筛选或者天然产物的全合成后活性筛选等方式发现可以有效调控新生物通路的苗头化合物,结合药物化学策略优化小分子结构成特异性高活性分子探针,再利用化学生物学手段探索未知的分子生物学机理并进一步开发全新的生物医药靶点。基于新靶点的高通量小分子筛选和药物化学结合会进一步优化成药性(ADMET等),开发成临床药物。该课题组目前已经在小分子抑制乙肝病毒,生物钟调节(12h shift),小分子诱导蛋白降解以及激酶抑制剂方向都有临床前药物分子在研发并获批多项相关专利。同时课题组在Nature Chemistry、Nature Methods、PNAS、JACS、Angew和JMC等医药研发与合成化学领域发表多篇文章。齐湘兵实验室在国内顶尖大学如清华、北大、协和、北师大、中国农大等学校都有博士研究生招生资格,毕业时颁发相应学籍单位的博士学位证书。组内学术气氛浓厚,师生关系融洽。请有兴趣的读者联系交流与合作。
课题组主页:http://qigroup.nibs.ac.cn
撰稿人:诗路化语 / 超级玛丽
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn