

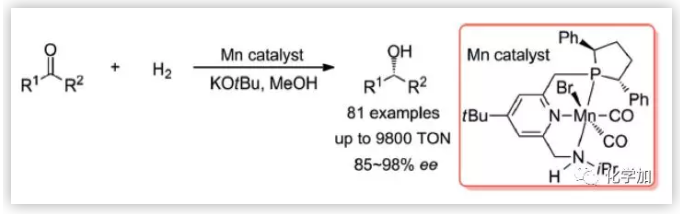
酮的不对称氢化反应是制备手性醇的重要方法之一,然而,目前此类反应通常使用贵金属如铑、钌或铱等催化剂。尽管近年来手性廉价金属如铜、镍、铁或钴等催化的不对称氢化反应取得了一定的进展,但是,它们的反应活性和对映选择性仍然面临很大的挑战。Clarke小组引入了第一个手性锰催化剂Mn-1,其用于芳基烷基酮的不对称氢化,ee值最高可达97%。为了使ee值保持在80%以上,酮上必须有一个大位阻的烷基(如tBu)。Beller小组开发了Mn-2催化的二烷基酮的不对称氢化反应,其ee值最高可达84%(图1)。尽管锰催化的酮的不对称氢化反应已经有了一定的发展,但仍面临反应活性、选择性差和底物范围窄等问题。作者通过对配体的电性和空间位阻的微调,设计了一类新型的结构可调的手性钳形锰络合物,从而极大地改变了这种情况。
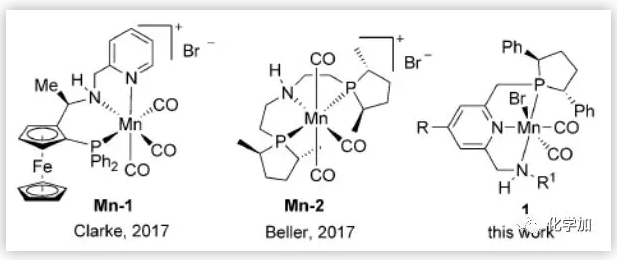
图1. 用于不对称氢化反应的手性Mn催化剂(来源:Angew. Chem. Int. Ed.)
手性PNN配体2结合了Milstein非手性PNN骨架和Fiaud手性磷杂环戊烷结构的特征。以3a-e为原料可以很容易的合成,然后再与Mn(CO)5Br反应,成功的得到相应的锰络合物1a-f。31P NMR谱表明这些配合物由两个异构体组成,其比值在1:1-4:1之间,这可能是由于其NH部分相对于Mn-Br键的顺式和反式取向所致。(R,R)-1d和(S,S)-1e的固态结构通过X-射线单晶衍射确定(图2)。
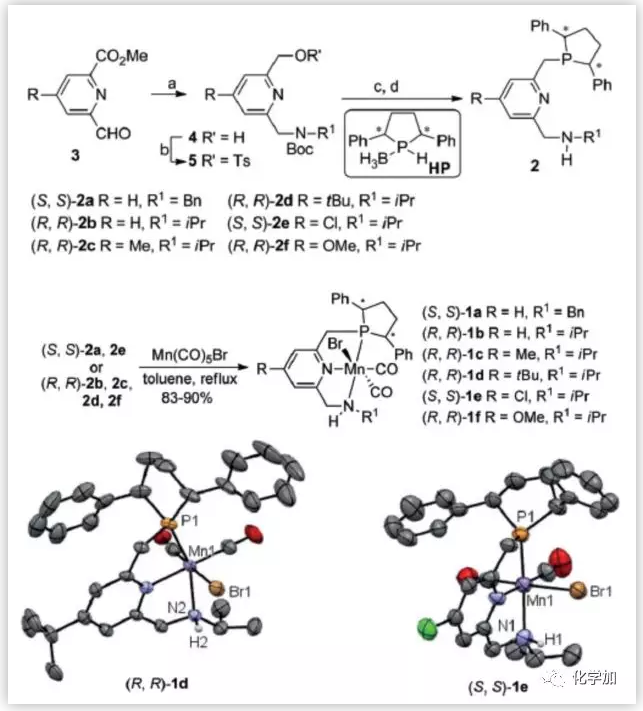
图2. PNN配体和锰络合物的合成(来源:Angew. Chem. Int. Ed.)
然后,作者对这些锰络合物在苯乙酮氢化反应中的催化效率进行了研究(图3)。发现向反应中加入醇如iPrOH,CF3CH2OH (TFE)和(CF3)2CHOH (HFIP)会影响这些锰催化剂的活性和选择性。最好的添加剂是HFIP。吡啶环的4-位带有tBu基的络合物(R,R)-1d是最好的催化剂,能够以90%的ee值得到(R)-7a。当催化剂负载量减少到0.01 mol%时,反应在60oC下反应48 h能以98%的转化率和86%的ee值得到(R)-7a,催化剂转化数TON可达9800。
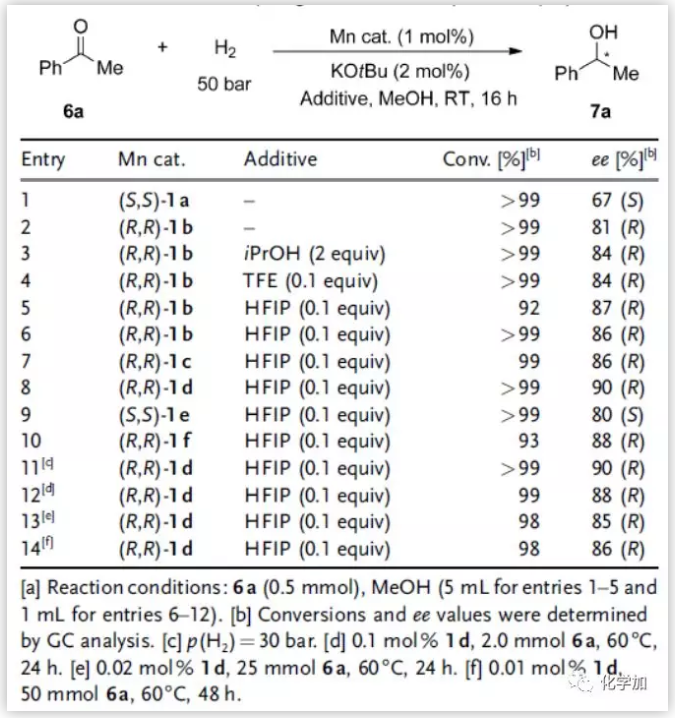
图3. 条件优化(来源:Angew. Chem. Int. Ed.)
作者接下来考察了反应的底物范围(图4)。各种芳基烷基酮和杂芳基酮都可以85-97%的ee值合成相应的手性仲醇7b-z和7aa-ad。脂肪酮6ae以80%的产率合成7ae,但其对映选择性不高(31% ee)。该催化体系对酮类化合物具有很高的化学选择性,可耐受碳-碳双键、酯和酰胺等。氨基酮6ah-ak也同样适用于该方法。值得注意的是,手性醇7j、7t、7aj、7ak、7al和7am分别是合成手性药物卡巴拉汀、苯肾上腺素、度洛西汀、伊折麦布和孟鲁司特的关键中间体。
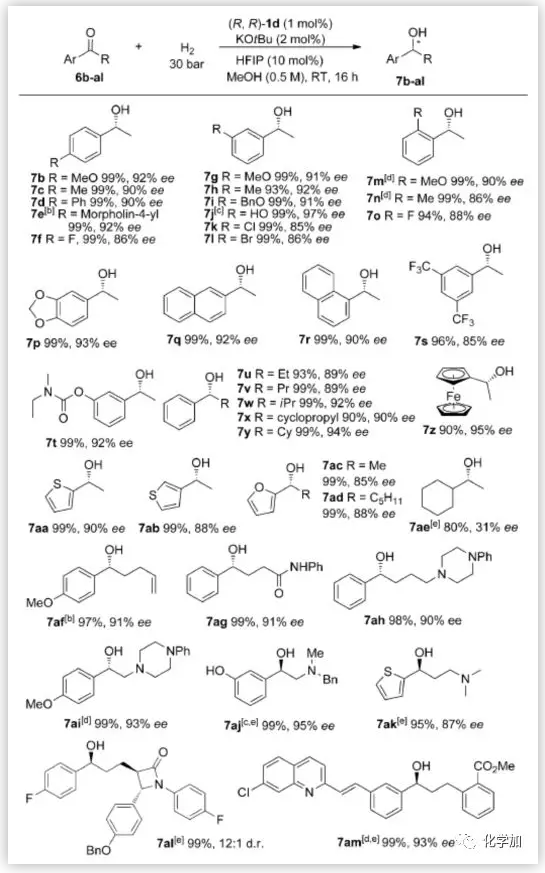
图4. 底物拓展(来源:Angew. Chem. Int. Ed.)
苯并稠酮(8a-z)在该反应模式下也具有很高的选择性,以几乎定量的产率和优异的对映选择性得到相应的手性醇9a-z。具有空间位阻的α,α-二取代酮8ac可以被顺利还原,以97%的ee值得到相应的醇9ac,它是Maruoka手性硒催化剂的关键中间体。含脲的酮8ad也以98%的产率和92%的ee值得到(S)-9ad,它是醋酸艾司利卡西平的关键中间体(图5)。
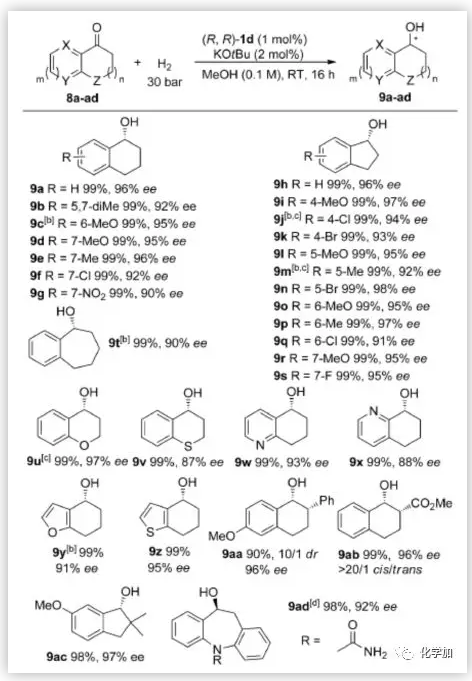
图5. 苯并稠酮的底物范围(来源:Angew. Chem. Int. Ed.)
二芳基酮的催化不对称氢化是具有挑战性的,因为催化剂很难区分底物上两个结构相似的芳基。而该反应体系对于邻位取代二苯甲酮10a-m具有很高的选择性,以几乎定量的产率和良好至优异的ee值(86-98%)合成了一系列不对称苯甲醇11a-m,其中11e和11h分别是合成抗组胺药(S)-orphenadrine和(R)-neobenodine的前体(图6)。
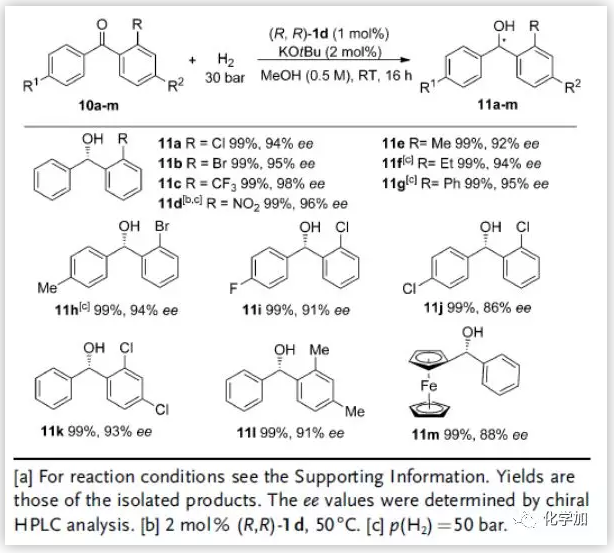
图6. 二芳基酮的底物范围(来源:Angew. Chem. Int. Ed.)
为了进一步说明该反应的可制备潜力,在催化剂负载量减少的情况下,对相应的酮进行了克级规模实验(图7)。当催化剂负载量为0.01 mol%时,8a在50 mmol规模下进行,以95%的产率和90%的ee值得到(R)-9a。在0.1 mol%催化剂存在下,酮6j、10h和手性配体前体8ac以几乎定量的收率和优异的对映选择性生成相应的醇7j、11h和9ac。
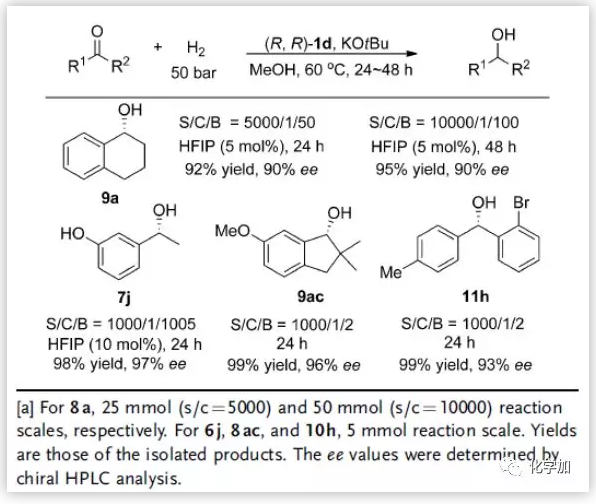
图7. 反应的放大性潜力(来源:Angew. Chem. Int. Ed.)
作者通过控制实验研究了反应的机理。使用(S,S)-1g作为催化剂,反应活性和对映选择性急剧下降,表明配体中的NH官能团对于实现高反应活性和高对映选择性是至关重要的。此外,当使用分离纯的顺式-(R,R)-1d时,反应的活性和对映选择性与使用顺式/反式(4:1)的结果相同。而顺式/反式(4:1)的(R,R)-1d与2当量KOtBu在[D4] MeOH中反应,通过31P NMR谱只观察到新的单一信号,表明催化剂前体(R,R)-1d可能转化为Mn-OCD3活性物种13。总的反应过程可能是通过配体中的N-H官能团和锰-氢单元以outer-sphere活化模式与酮羰基发生相互作用(图8)。
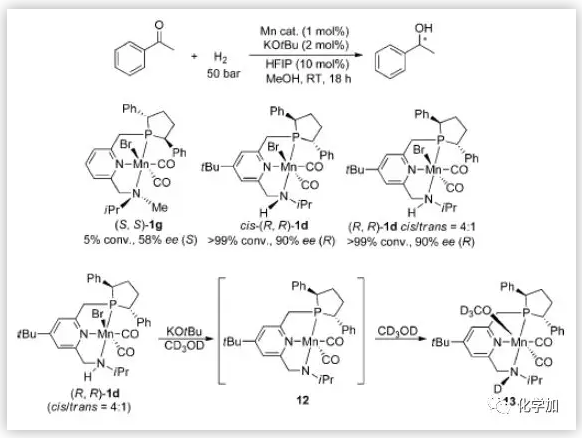
图8. 反应机理(来源:Angew. Chem. Int. Ed.)
总结:中科院上海有机所丁奎岭院士团队报道了一类新型的模块化、结构可调的手性钳形锰络合物,并成功的应用于酮的不对称氢化反应。该方法具有优秀的反应活性(TON最高可达9800)、优异的对映选择性(85-98% ee)、良好的官能团兼容性以及非常广泛的底物范围(81个例子),还可应用于多种药物关键手性中间体的不对称合成,在有机合成和药物合成中都具有重要意义。
撰稿人:残月
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn