

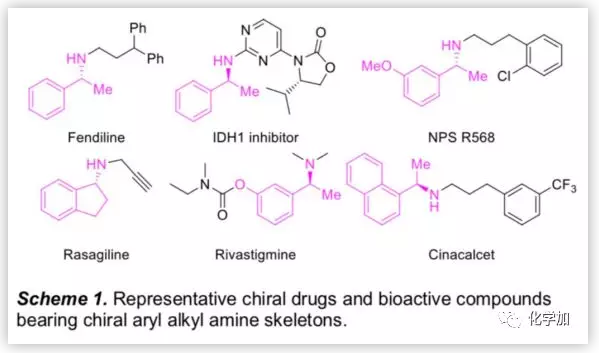
手性胺是光学活性物质、药物分子和配体等多功能手性分子中的重要结构单元(Scheme 1)。在手性胺的诸多合成策略中,亚胺的不对称催化氢化已成为最实用和最有效的方法之一。在过去的几十年中,基于Rh,Ru,Ir和Pd等过渡金属的催化剂已广泛用于各种亚胺的不对称氢化,且反应产率良好,但由于过渡金属昂贵的价格,大大限制了其广泛应用。所以,有机合成化学家更加关注于开发价格低廉的过渡金属催化剂,尽管这些过渡金属催化剂具有优异的对映选择性和产率,但仍存在明显的不足,特别是在催化效率上,所报道的文献中,底物与催化剂的质量比值(S/C)大都小于1000,这也大大限制了它们在工业规模的不对称催化氢化中的应用。因此开发高效低廉的不对称氢化催化剂显得十分重要。
(图片来源:Angew. Chem. Int. Ed.)
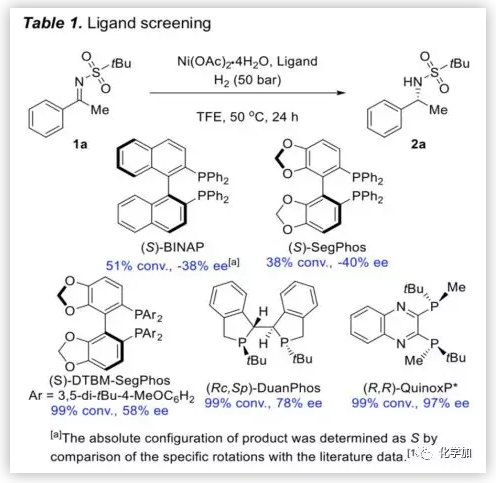
首先,作者以(E)-2-甲基-N-(1-苯基亚乙基)丙烷-2-磺酰胺(1a)作为标准底物,在H2(50 bar),50 ℃和三氟乙醇(TFE)的反应条件下,考察了许多手性二膦配体(Table 1)。可以看出,当使用轴向手性配体(S)-BINAP和(S)-SegPhos时,其具有中等催化效率和低对映选择性,与(S)-SegPhos相比,含有高度取代苯环的(S)-DTBM-SegPhos显示出更优异的催化活性和对映选择性,富电子的配体(Rc,Sp)-DuanPhos具有99%的转化率但ee值仅为78%。而(R,R)-QuinoxP*作为配体时,反应能以99%的产率和97%ee值生成相应产物。
(图片来源:Angew. Chem. Int. Ed.)
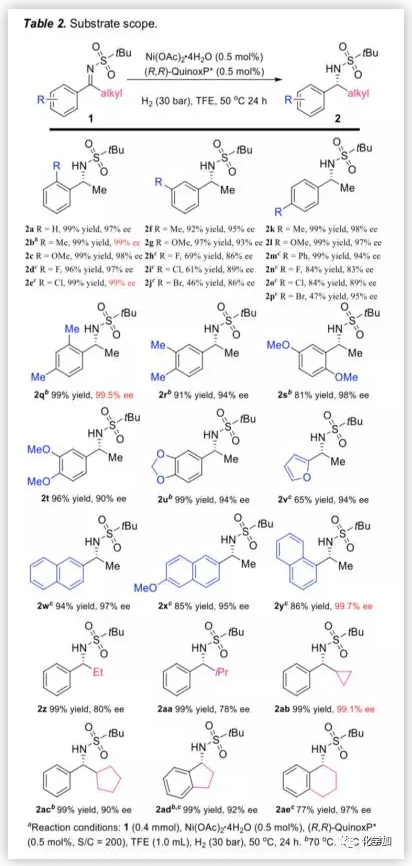
基于最优反应条件,作者对亚胺底物的适用范围进行了考察(Table 2)。结果表明,当给电子取代基或吸电子取代基存在于2-,3-或4-位时(2b -p),反应均能以中等到优异的产率和对映选择性得到相应产物。此外,无论是二取代底物,苯并环底物还是呋喃基或萘基取代的底物,均能以良好至优异的对映选择性得到产物(2v-y,1ad,1ae)。接着,作者考察了带有不同烷基的底物,当甲基被乙基、异丙基、环丙基或环戊基等烷基取代时,反应也能以高转化率和优异的对映选择性得到相应产物(2z-ac)。
(图片来源:Angew. Chem. Int. Ed.)
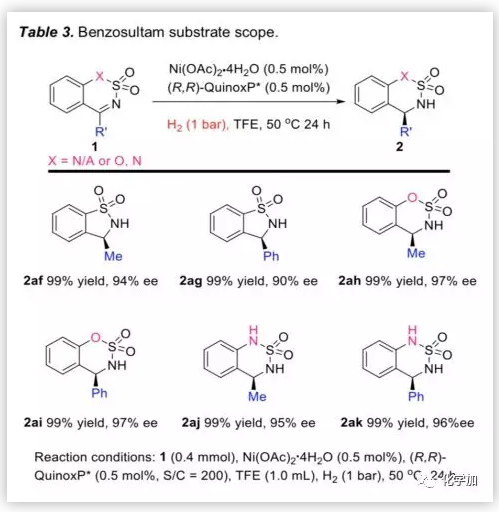
为了进一步扩展底物的适用范围,作者考察了带有甲基或苯基的环状N-磺酰亚胺底物(Table 3)。在H2(1 bar)和0.5 mol%催化剂负载量的条件下,无论是五元环状底物还是含氧或氮的六元环状底物,反应均能以优异的产率和ee值生成相应产物。
(图片来源:Angew. Chem. Int. Ed.)
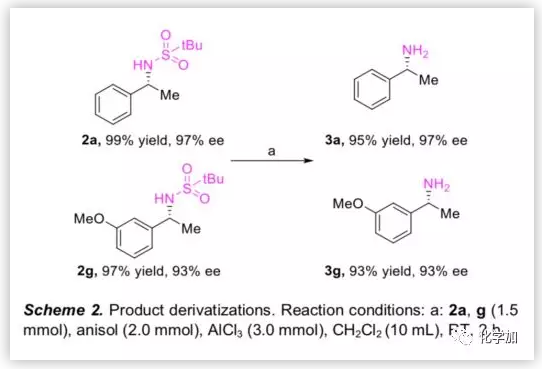
然后,作者用AlCl3脱除2a和2g的tBu-磺酰基,以优异的产率分别得到手性胺3a和3g,且没有ee值损失(Scheme 2),这些手性胺可进一步转化为各种手性药物和生物活性化合物,如Fendiline(芬地林),IDH1抑制剂,NPS R568和Rivastigmine(卡巴拉汀)等。
(图片来源:Angew. Chem. Int. Ed.)
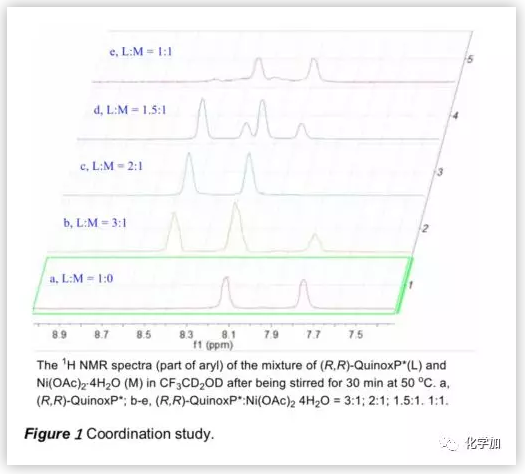
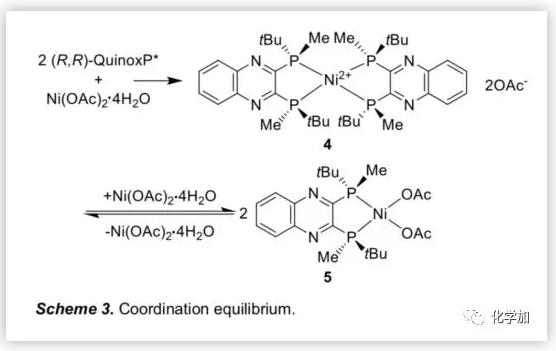
接下来,作者利用1H NMR研究了(R,R)-QuinoxP*与Ni(OAc)2.4H2O在d3-TFE中的配位行为(Figure 1)。结果表明,Ni盐与其配合物之间存在配位平衡,以2/1和1/1的比例(配体/Ni盐)形成的主要配合物分别为4和5(Scheme 3)。
根据上述配位行为,作者研究了Ni(OAc)2.4H2O与(R,R)-QuinoxP*的配位比例变化对不对称氢化的影响。结果表明,过量的Ni盐能够促进活性Ni配合物5的形成,从而提高氢化效率。
(图片来源:Angew. Chem. Int. Ed.)
(图片来源:Angew. Chem. Int. Ed.)
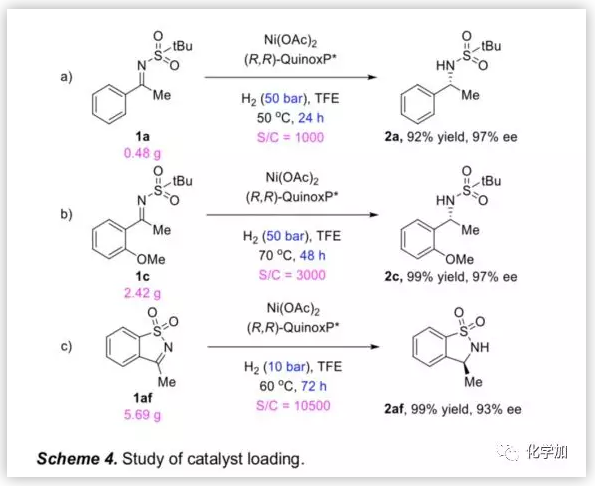
为了考察反应体系的催化效率,作者研究了底物1a,1c及1af在低催化剂负载量,无水Ni(OAc)2 及20/1(Ni盐与配体)的条件下的氢化。1a在S/C=1000条件下,以92%的产率和97%的ee值得到产物(Scheme 4a)。在S/C=3000的条件下反应48 h,1c以97%ee值完全转化成相应产物(Scheme 4b)。而在低催化剂负载量(0.0095 mol%,S/C = 10500)的存在下,环状底物1af实现了完全氢化,且以93%ee值得到产物2af(Scheme 4c)。结果表明,该反应在低催化剂负载量的条件下可高效催化反应。
(图片来源:Angew. Chem. Int. Ed.)
为了研究不对称氢化的反应机理,作者进行了氘代实验,在40 bar的D2条件下,结果显示氘添加到前手性碳上(Scheme 5)。该结果表明,Ni-催化的反应机理类似于Pd-催化亚胺不对称氢化的反应机理。
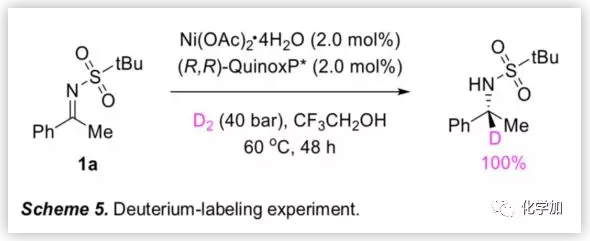
(图片来源:Angew. Chem. Int. Ed.)
基于氘代实验,作者用C1作为活性催化剂,计算并研究了1a氢化的催化循环机理的可行性(Scheme 6)。首先,催化剂C1通过其前手性平面与底物1a配位形成R1或S1,R1中的Ni-H和C=N键的共面取向有利于氢化物转移,而含有六元环的S1比R1稍微稳定,但其反应活性显著降低。由于TS(R)中稳定的分子内相互作用,导致竞争性过渡态TS(R)和TS(S)之间存在5.0 kcal/mol的自由能差异。此外,TS(R)中催化剂和底物之间的弱吸引相互作用也有助于催化活性。
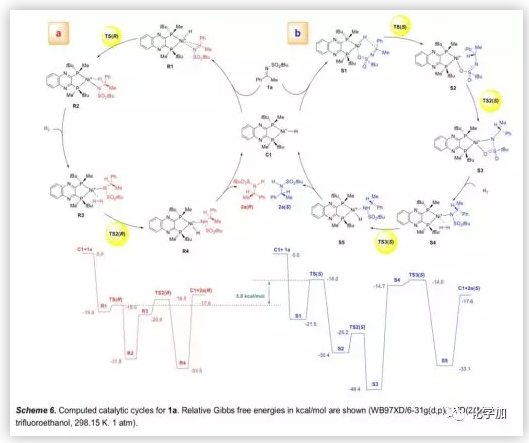
(图片来源:Angew. Chem. Int. Ed.)
总结:上海交通大学张万斌教授课题组开发了Ni-催化N-磺酰亚胺不对称氢化的合成新策略,为合成手性胺提供了新途径。该反应具有高催化效率(S/C高达10500)和优异的对映选择性且底物适用范围广,极大地推动了不对称氢化的快速发展。
撰稿人:Effie小迷弟
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn