

双芳基轴手性化合物(特别是含氮杂芳烃的轴手性化合物)广泛存在于具有生物活性和药理活性的化合物中。因此,开发构建双芳基轴手性化合物的新方法一直是研究人员努力追求的目标。其中,通过过渡金属催化邻位C-H键官能团化构建轴手性结构的方法表现尤为突出,且该方法得到了广泛的应用。限制该方法的两个主要原因是:1)竞争背景反应和C-H键活化所需的高温易导致产物消旋;2)选择合适的能同时控制反应活性和立体选择性的手性配体是极其困难的。因此,寻找合适的配体成为大家关注的重点。
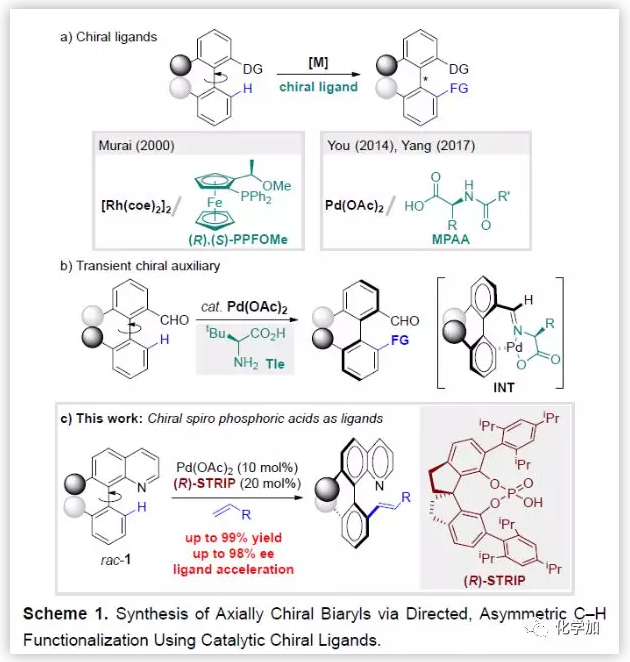
2000年,Murai课题组报道了[Rh(coe)2]2和手性二茂铁基络合物[(R),(S)-PPFOMe]催化不对称的双芳基C-H键烷基化反应。关于该催化体系的报道只有一例,且不对称选择性较低(Scheme 1a)。2014年,余金权课题组报道了Pd(OAc)2和单保护的氨基酸共同催化C-H键发生碘化反应构建双芳基轴手性骨架(Scheme 1a)。
受到余金权课题组工作的启发,史炳锋课题组报道了Pd(OAc)2和叔亮氨酸共同催化双芳基醛的C-H键官能团化,构建具有高不对称选择性的双芳基轴手性骨架(Scheme 1b)。该课题的局限在于底物中一定要带有醛基,这限制了轴手性喹啉衍生衍生物的合成。因此,作者又发展了Pd和螺环手性磷酸阴离子配体催化不对称芳香族化合物发生C-H键烯烃化反应合成双芳基轴手性喹啉衍生化合物(Scheme 1c)。
(图片来源:Angew. Chem. Int. Ed.)
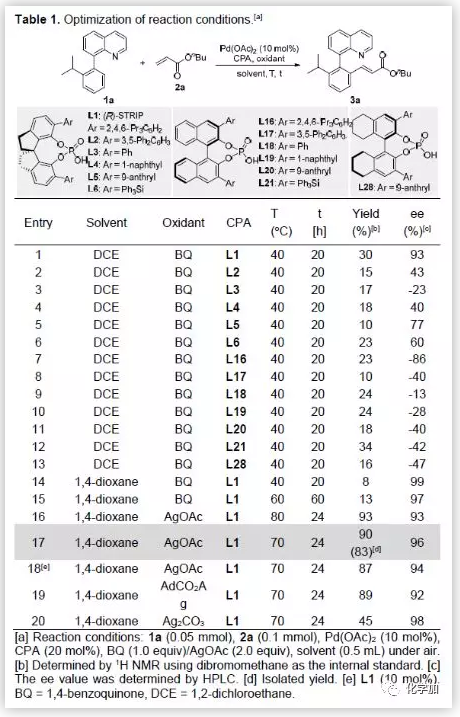
以联芳基喹啉衍生物1a和丙烯酸酯1b作为模板底物,作者对该反应条件进行反复筛选,最终得到最佳条件是(Table 1)为:,10 mmol% Pd(OAc)2和20 mmol%手性磷酸L1作为催化剂,1,4-二氧六环作为溶剂,在70 ℃条件下反应24小时, 以收率为90%、不对称选择性为96%获得目标产物。值得一提的是,之前报道过的催化体系都不太适合该反应,均以低不对称选择性获得目标产物。
(图片来源:Angew. Chem. Int. Ed.)
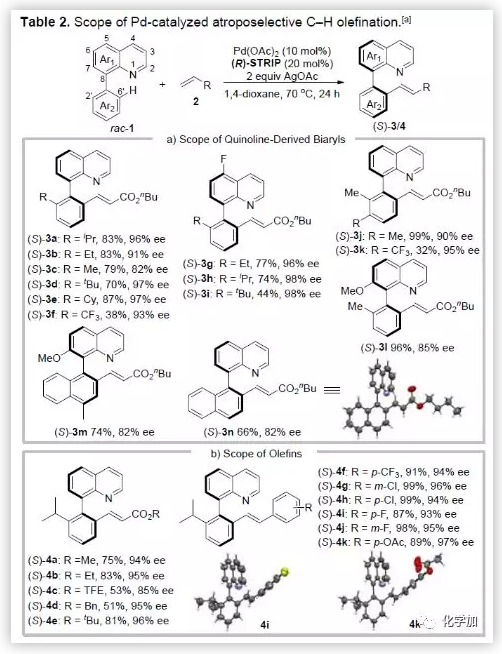
在最优条件下,作者考察了该反应的底物范围(Table 2)。一系列不同取代的联芳基喹啉衍生物均能很好的适应反应条件。2'-位取代基位阻越大,相应的对映选择性会有所提高。值得一提的是,带有吸电子取代基的底物通常比带给电子取代基的底物的反应性低,但其对映选择性不受电子效应的影响。各种取代的丙烯酸酯也能很好的适应反应条件,可以得到收率和不对称选择性均较高的相应产物。令人高兴的是,各种取代的苯乙烯也具有良好的耐受性,得到相应产物的收率和不对称选择性均较高。
(图片来源:Angew. Chem. Int. Ed.)
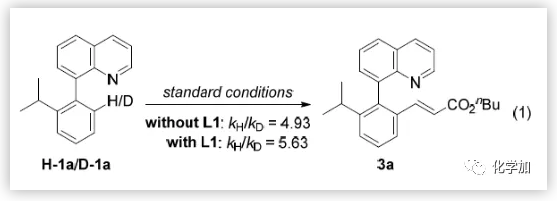
为了更好的阐明反应机制,作者又进一步做了一些控制实验(eq 1)。在标准条件下,加入络合物L1的KIE值为5.63,而不加络合物L1的KIE值为4.93。这说明C-H键断裂是限制该可逆反应的关键步骤。同时可以观察到3a的ee值与L1呈线性关系,说明络合物对不对称选择性起着至关重要的作用。
(图片来源:Angew. Chem. Int. Ed.)
紧接着,作者做了密度泛函理论(DFT)计算,计算结果表明手性磷酸盐作为缓冲离子对来稳定Pd,醋酸盐作为碱参与CMD型C-H键的活化。同时,通过计算阐明了生成S构型产物的原因(Figure 2)。
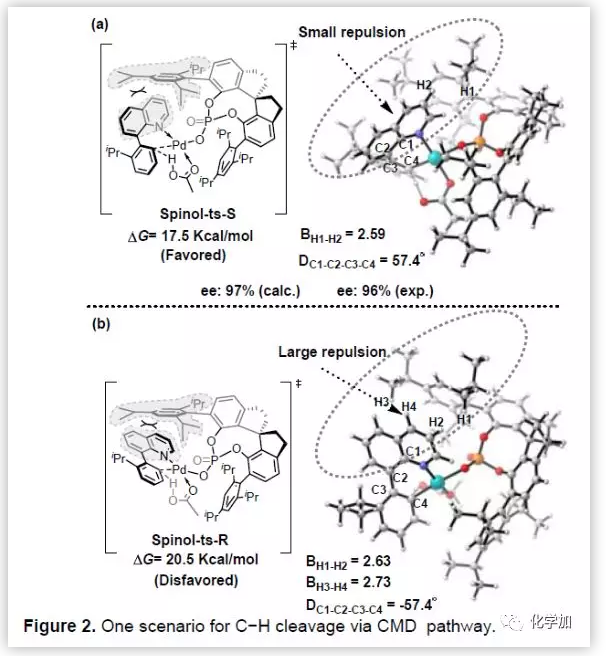
(图片来源:Angew. Chem. Int. Ed.)
四氢喹啉衍生物广泛存在于众多生物活性天然产物和药物中,所以作者紧接着对模板产物进行还原反应,以98%的收率和96%的不对称选择性获得手性四氢喹啉衍生物(eq 2)。
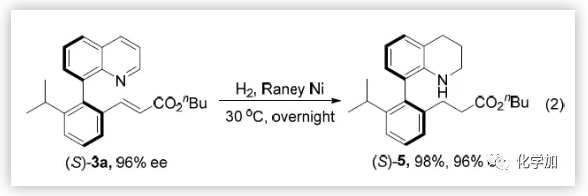
(图片来源:Angew. Chem. Int. Ed.)
小结:史炳锋、林旭锋团队报道了Pd(II)/STRIP催化体系催化芳香族化合物的不对称C-H键烯烃化反应,能以优良的收率和不对称选择性得到双芳基轴手性喹啉衍生物。该报道极大地丰富了不对称C-H键烯烃化反应的催化策略。
撰稿人:暖冬
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn