

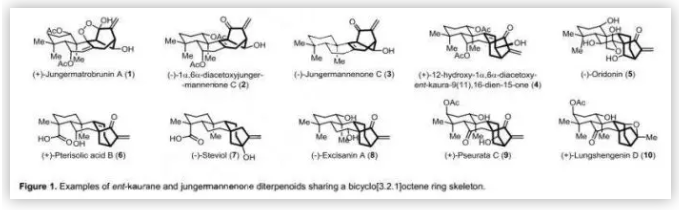
对映-贝壳杉烯二萜类化合物是一类结构复杂的桥连多环天然产物,具有多种生物活性,包括抗癌、抗真菌和抗病毒活性。从生源合成假说可以看出,jungermannenones是对映-贝壳杉烯二萜通过碳正离子重排途径生成的,其家族成员包括:(+)-jungermatrobrunin A (1)、(-)-1α,6α-diacetoxyjungermannenone C (2)、(-)-jungermannenone C(3)、(+)-12-hydroxy-1α,6α-diacetoxy-ent-kaura-9(11), 16-dien-15-one (4)、(-)-oridonin (5)、(+)-pterisolic acid B (6)、(-)-steviol (7)、(-)-excisanin A(8)、(+)-pseurata C(9)和(+)-lungshengenin D(10)等具有共同的双环[3.2.1]环结构。几十年来,其复杂的结构和潜在的生物活性引起了合成化学家们的密切关注。
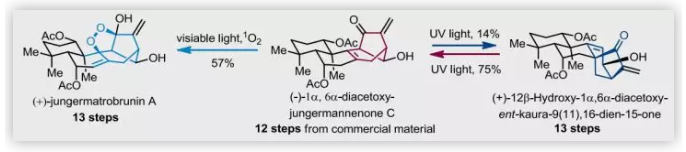
(+)-jungermatrobrunin A(1)与(-)-2和(+)-4均是由山东大学娄红祥课题组从地钱(Jungermannia atrobrunnea)中分离得到的,其中(+)-1具有抗真菌活性。从合成的角度来看,(+)-1具有高度氧化的结构以及独特的双环[3.2.1]辛烯骨架和过氧桥结构,这暗示其具有潜在的抗疟作用。近日,北京大学雷晓光课题组通过后期光诱导的骨架重排完成了(+)-1、(-)-2和(+)-4的不对称全合成,该成果发表在近期Angew. Chem. Int. Ed.上。
(图片来源:Angew. Chem. Int. Ed.)
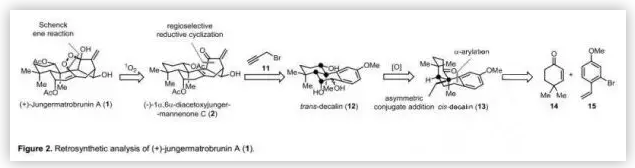
(+)-jungermatrobrunin A(1)的合成策略(Figure 2):由于(+)-1和(-)-2源于同一植物,作者认为(+)-1可以由(-)-2通过仿生光诱导的Schenck-ene反应得到,而(-)-2中拥挤的双环[3.2.1]辛烯骨架可以由三醇12通过自由基介导的还原环化构建。反式-十氢化萘12可以通过顺式-十氢化萘13合成,而后者的三环骨架可以由市售的14和15通过不对称共轭加成和随后的α-芳基化快速构建。
(图片来源:Angew. Chem. Int. Ed.)
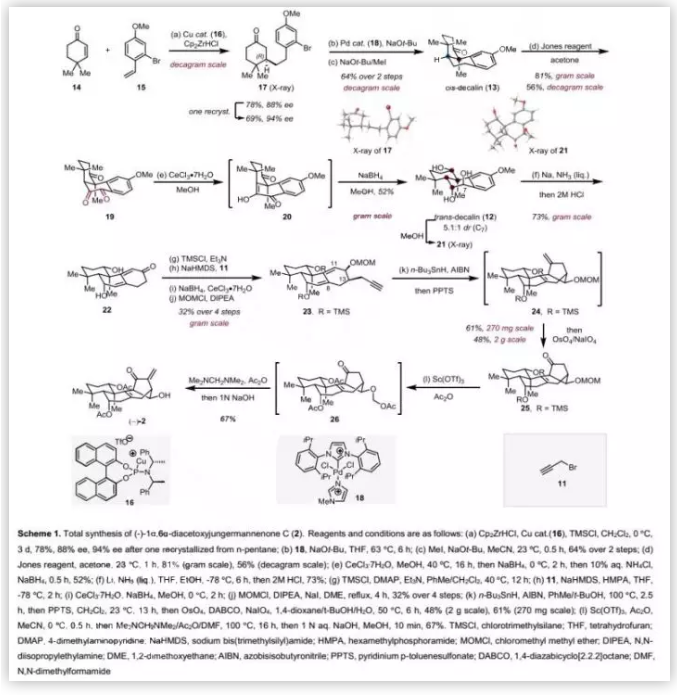
具体的合成路线(Scheme 1):首先,作者按Fletcher报道的方法将烯酮14与苯乙烯15进行不对称共轭加成得到环己酮17(78%,88% ee),重结晶后ee提高至94%,其绝对构型通过单晶X-射线衍射确证。随后,17经过Pd(II)-NHC(18)催化的分子内α-芳基化、环己酮的区域和非对映选择性甲基化得到顺式-十氢化萘13(64%),然后用Jones试剂对苄位和高苄位进行选择性双重氧化得到α-二酮19(81%)。随后,作者尝试通过酮-烯醇互变异构化从顺式-十氢化萘13合成反式-十氢化萘。首先,作者尝试了报道的Brønsted酸或碱性条件,均未能将C6位羰基互变异构成α-酮烯醇20;接下来,作者广泛筛选了Lewis酸,并发现用CeCl3·7H2O/MeOH处理19后,再用NaBH4还原可以得到α-酮烯醇20。此外,作者以52%的收率得到反式-十氢化萘12,并且为C7位非对映异构体混合物(5.1:1, dr)。最初,12的主要异构体结构通过2D NMR确定;随后,作者通过其衍生物二醇21的单晶X-射线衍射确证。十氢化萘12经Birch还原和甲基烯醇醚的酸水解得到二烯酮22,然后经四步转化(二醇的TMS保护、立体选择性α-炔丙基化、二烯酮的Luche还原和双烯丙基醇的MOM保护)以32%的总收率得到二烯炔23。在得到二烯炔23后,作者尝试用1,6-二烯环化构建具有挑战性的双环[3.2.1]辛烯骨架。首先,作者用HSn(Bu)3处理23得到jungermanneone-型骨架24作为单一产物,然后经外式亚甲基的原位氧化裂解以61%的收率得到酮25(克级规模收率为48%)。接下来,作者用Sc(OTf)3/Ac2O处理25,其TMS和MOM保护基均被Ac替换生成三乙酸酯26,最后经原位α-亚甲基化和(碱性条件下)选择性脱除C12位保护基以67%的收率得到(-)-2。
(图片来源:Angew. Chem. Int. Ed.)
完成(-)-2的全合成后,作者将注意力转向光诱导单线态氧的Schenck-ene反应以构建(+)-1的过氧桥。然而,当(-)-2暴露于紫外光(365 nm)时,即使在O2和光敏剂存在下,未观察到(+)-1,反而是观察到了唯一产物(+)-4。随后,作者用365 nm紫外线照射(-)-2的甲醇溶液仅以14%的分离收率得到(+)-4,其中81%的(-)-2得到回收。无法实现(-)-2到(+)-4的完全转化,表明(-)-2与(+)-4之间的转化存在平衡。作者用实验证实了这一假设:用UV(254 nm)照射(+)-4时,以75%的分离收率得到(-)-2,并认为对映-贝壳杉烯至jungermannenone骨架重排可能通过光诱导的β,γ-不饱和酮的1,3-酰基迁移进行。
(图片来源:Angew. Chem. Int. Ed.)
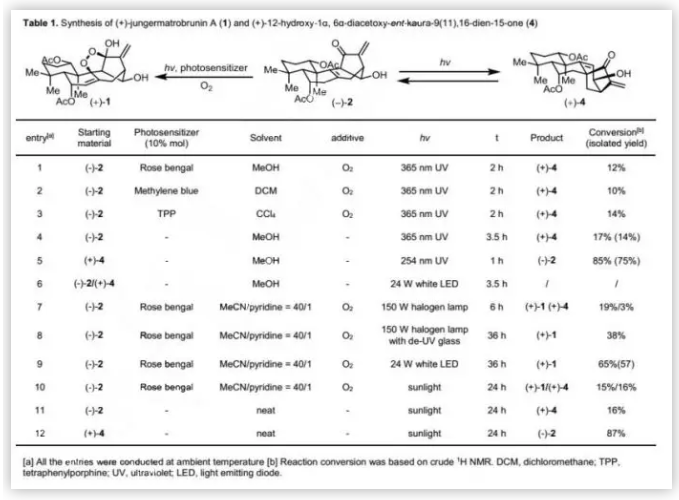
接下来,作者对Schenck-ene反应的条件进行了广泛筛选(Table 1),并发现用150 W卤灯和玫瑰红在共溶剂(甲醇/吡啶=40/1)中可以19%的转化率得到(+)-1和3%的转化率得到重排产物(+)-4。考虑到紫外、可见光在内的卤灯的光谱范围很宽,作者猜测紫外光诱导的重排可能影响Schenck-ene反应。当用卤灯配备紫外光过滤器时,可以38%的转化率得到单一产物(+)-1;进一步优化发现,当用24 W白光LED灯照射(-)-2时,可以57%的分离收率(65%转化率)得到单一产物(+)-1。实验表明,可见光对双环[3.2.1]辛烯重排没有任何影响。总之,上述研究表明,可见光有利于Schenck-ene反应,而紫外光有利于双环[3.2.1]辛烯重排。
由于(+)-1、(-)-2和(+)-4均是从地钱Jungermannia atrobrunnea中分离得到;同时,阳光(包含紫外光和可见光)是最常见的光源。因此,作者认为(+)-1和(+)-4可能均是衍生自(-)-2。为了进一步探索其生源关系,作者在光照下进行了光诱导的反应。当(-)-2在先前的反应条件下暴露于阳光时,得到(+)-1和(+)-4的混合物;当(-)-2或(+)-4在纯净条件下暴露于阳光时,光诱导的骨架重排转化率分别为16%和87%。
小结:北京大学雷晓光课题组通过双环[3.2.1]-辛烯环的多样性光诱导骨架重排经过12-13步完成了(+)-jungermatrobrunin A(1)、(-)-2和(+)-4首次不对称全合成。通过光化学研究发现,紫外光有利于双环[3.2.1]辛烯重排得到(+)-4,而可见光有利于Schenck-ene反应得到(+)-1。此外,作者通过研究表明光化学反应也可能发生在对映-贝壳杉烯二萜类化合物的生物合成中,并认为光诱导的1,3-酰基迁移在天然产物合成中将具有更广泛的应用。
撰稿人:爽爽的朝阳
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn