

吲哚骨架广泛存在于生物活性结构和药物分子中,由于吲哚中吡咯侧具有较高的亲核性,化学家们已成功地在吲哚的C2或C3位实现了选择性的C-H官能团化。近年来,利用吲哚氮原子上的可脱除导向基团(DG),在C6或C7位引入官能团的方法也得到了发展。而直接构建C4位官能团化的吲哚是一个尚未解决的问题,引起了人们的广泛关注(图1a)。
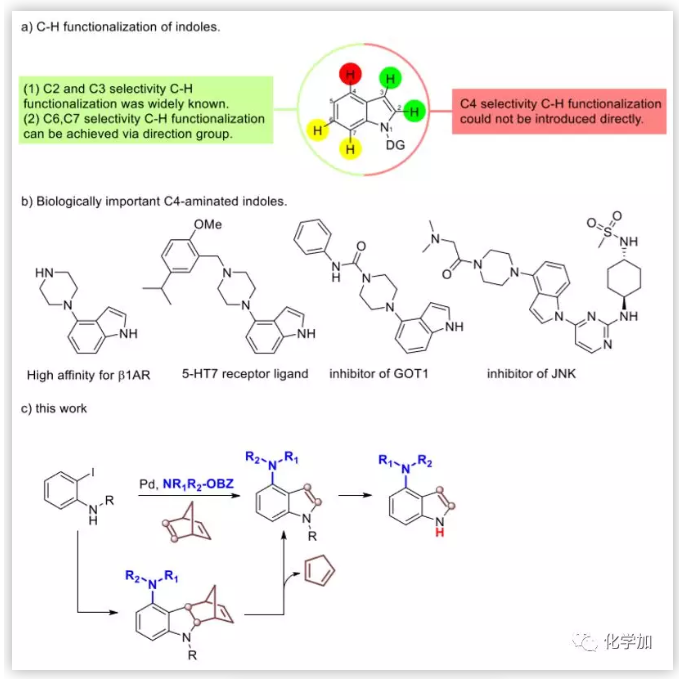
图1. 4-氨基吲哚的合成方法及其生物活性(图片来源:J. Am. Chem. Soc.)
4-氨基吲哚是一种具有广泛生物活性的分子骨架,其中4-哌嗪吲哚可作为G蛋白受体(GPCR)靶点的分子砌块。GPCR靶标已成为制药业的一个重要研究热点,在过去的10年中已经推出了60多种新的GPCR药物 (图1b)。尽管具有4-氨基吲哚骨架的化合物普遍具有生物活性,但其合成方法较少。因此,开发一系列的C-H胺化反应,从简单的原料中一步构建4-氨基吲哚骨架是非常有价值的。
2009年,M. Lautens等人使用降冰片二烯(NBD),并通过逆Diels-alder策略成功地获得了C2,C3-非取代的吲哚。当邻碘苯胺氮上的保护基为吸电子基时,反应选择性地向Buchwald偶联反应进行。当添加卤化烷烃时,仍然不能改变反应方向。2000年,M. Lautens首次使用膦配体来拓宽Pd/NBE的化学兼容性,并建立了Catellani-Lautens反应体系。2013年,董广彬首次利用亲电胺化试剂实现了邻位胺化反应,为设计和构建4-氨基吲哚提供了有力的工具。2016年,余金权首次开发了一种吡啶衍生物作为引导基团的间位C-H胺化反应,可用于合成3-氟-5-吗啉苯胺。在过去的20年中,M. Lautens等研究小组开发了一系列的分子内Pd/NBE反应来构建各种杂环或非杂环骨架。然而,通过多米诺反应一步构建C4官能团化吲哚骨架的研究至今未见报道。近日,兰州大学梁永民教授课题组通过Catellani和逆Diels-Alder策略高效合成了C4-氨基吲哚,文章发表在J. Am. Chem. Soc.上。
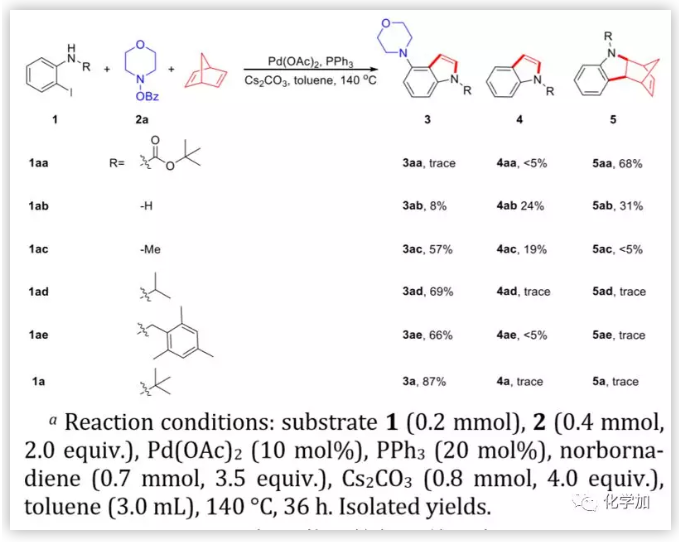
图2. 邻碘苯胺的保护基研究(图片来源:J. Am. Chem. Soc.)
首先,作者采用可脱除的叔丁氧基羰基(Boc)作为邻碘苯胺的保护基,用降冰片二烯(NBD)代替降冰片烯(NBE)作为Catellani反应的邻位C-H胺化的暂时媒介,期望一步合成4-氨基吲哚骨架结构。不幸的是,没有检测到想要的产物,发生了分子内Buchwald偶联,而没有进行逆Diels-Alder反应。以未保护的邻碘苯胺为底物,采用气相色谱-质谱(GCMS)技术,作者发现生成了少量的目标产物。一些直接分子内的Buchwald偶联产物5ab可通过逆Diels-Alder反应转化为4ab。作者推测,氮原子上的给电子基团可以使反应朝着邻位C-H胺基化方向反应,并促进逆Diels-Alder反应进行。因此,作者用N-甲基-邻碘苯胺作为底物。令人惊喜的是,获得了4-氨基吲哚产物3ac,产率为57%,几乎所有的5ac都转化为了4ac。随后,作者进一步研究了异丙基和叔丁基作为保护基,空间位阻对反应方向的影响。当使用叔丁基时,以87%的产率获得了4-氨基吲哚3a,GCMS未检测到其他副产物。此外,多取代苄基(1ae)作为保护基时也可以顺利得到目标产物。三苯基膦是该反应最好的配体。
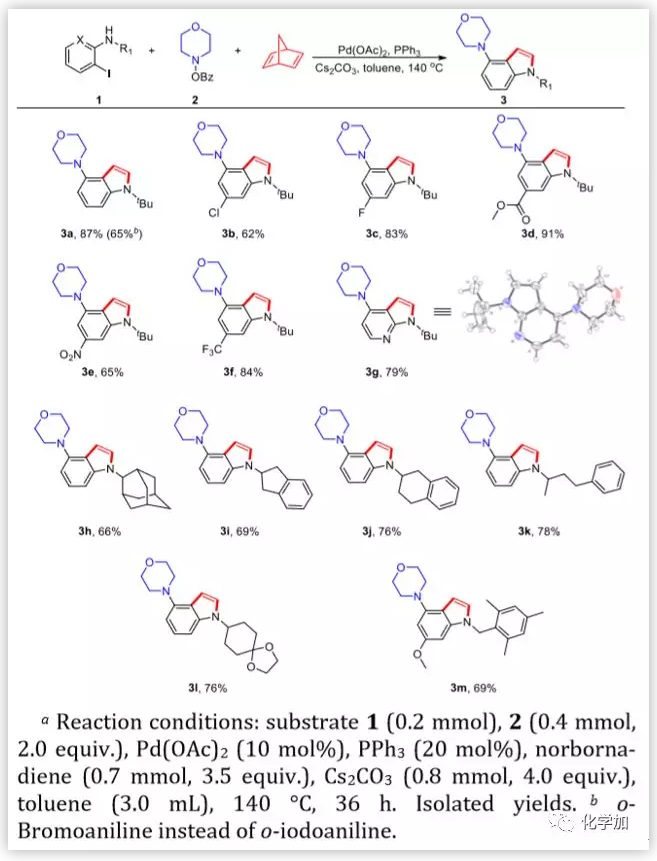
图3. 底物范围考察(图片来源:J. Am. Chem. Soc.)
接着,作者对底物范围进行了考察,首先研究了邻碘苯胺的底物范围。具有卤素(-F,Cl)和强吸电子基(-NO2)的邻碘苯胺与反应体系相兼容,并能以优异的收率得到所需的4-氨基吲哚产物(3b-3f)。值得一提的是,杂芳族底物3-碘吡啶-2-胺反应平稳,得到4-氨基-7-氮杂吲哚3g,收率79%。随后,作者扩大了邻碘苯胺氮原子上的基团范围。具有大位阻的金刚烷3h、二氢茚3i、四氢萘3j和含有芳基烃4-苯基-2-丁基的3k都能以优良的收率获得目标产物。这些实例表明,通过该反应可以合成一系列N-烷基取代的4-氨基吲哚。值得注意的是,吲哚与仲碳或叔碳的偶联反应目前是一个难题,该方法为合成这些吲哚衍生物提供了方便的途径。
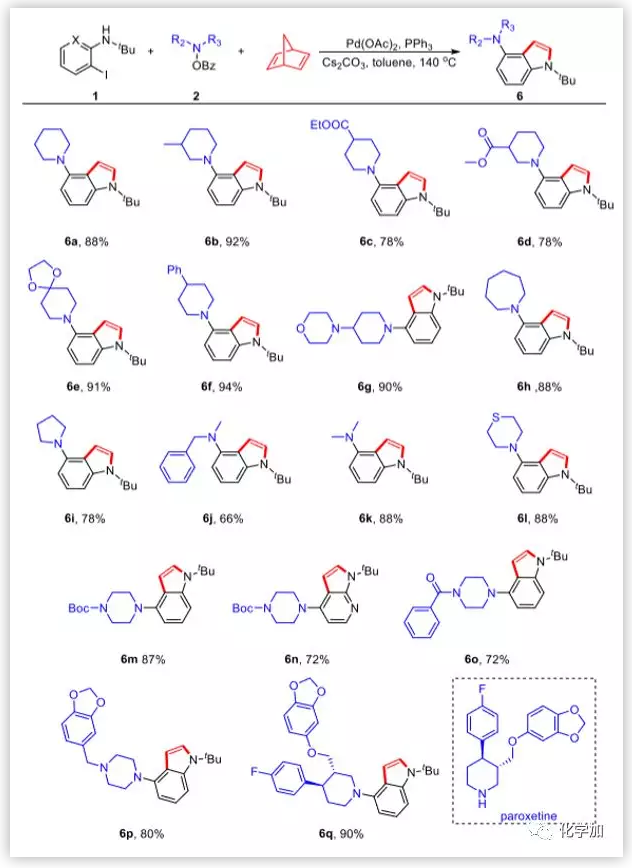
图4. 亲电胺化试剂的考察(图片来源:J. Am. Chem. Soc.)
作者继续扩大亲电胺化试剂的范围。不同取代基团的哌啶、硫代吗啉和Boc-保护的哌嗪衍生的胺化试剂均以优异的产率得到所需产物。非六环胺化试剂,例如氮杂环庚烷、吡咯烷、二甲胺和甲基苄基氨,也以优良的产率得到目标产物,而之前工作中这类亲电胺化试剂作为底物的产率非常低。特别地,抗抑郁药帕罗西汀的吲哚衍生物可以通过该方法直接得到(6q)。
为进一步证明该方法的实用价值,作者扩大了亲电试剂的范围。使用溴代烷基和芳基作为亲电试剂,并重新优化了反应条件。当使用N,N-二甲基甲酰胺代替甲苯作溶剂时,成功地得到4-烷基和芳基取代的吲哚。但该方法不能合成杂环吲哚衍生物。
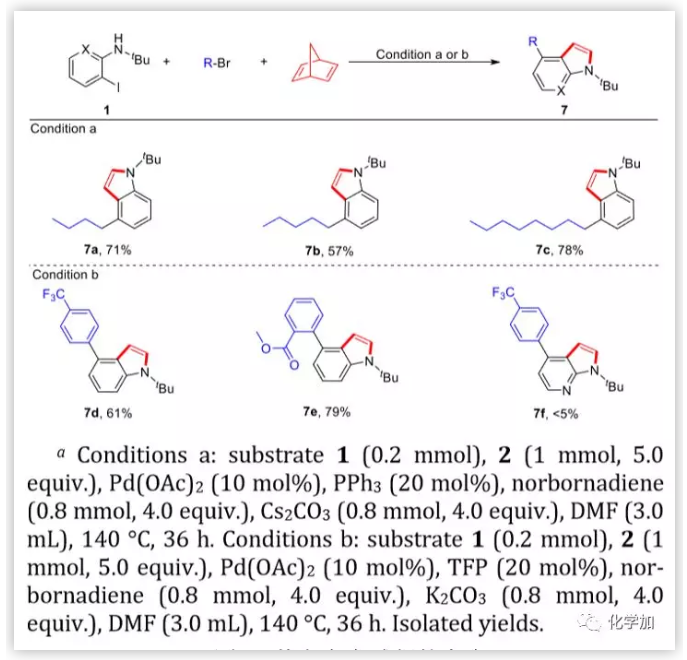
图5. 其它亲电试剂的考察(图片来源:J. Am. Chem. Soc.)
为了证明该方法的工业化潜力,在4 mmol规模上进行反应,能以79%的产率得到目标产物。药物化合物和天然产物通常含有未保护的N-H键,因此作者对4-氨基吲哚进行了脱保护实验。当氯化铝作Lewis酸并且在DCM中55 ℃下反应时,得到脱保护产物3ab,产率为76%。另外,作者还对吲哚3a进行了碘化和Friedel-Crafts三氟乙酰化。最后,根据Catellani的工作,作者尝试使用二苯乙炔和降冰片烯代替降冰片二烯,但是仅产生了痕量的所需产物10。这可能是由于脱降冰片烯过程速率远低于分子内Buchwald偶联(图6)。
在GPCR靶标的分子砌块4-哌嗪吲哚的合成中进一步证明了该方法的实用性,作者还利用它进一步合成了用于治疗胰腺导管腺癌的GOT1抑制剂。以前的方法非常不经济且对环境不友好,合成4-哌嗪吲哚需要3-5步且产率极低。通过新策略,作者通过一步三组分串联反应和简单的脱保护过程合成了4-哌嗪基吲哚。然后,在三乙胺存在下,将4-哌嗪吲哚和4-氯苯基异氰酸酯搅拌30分钟,得到GOT1抑制剂,收率46%。
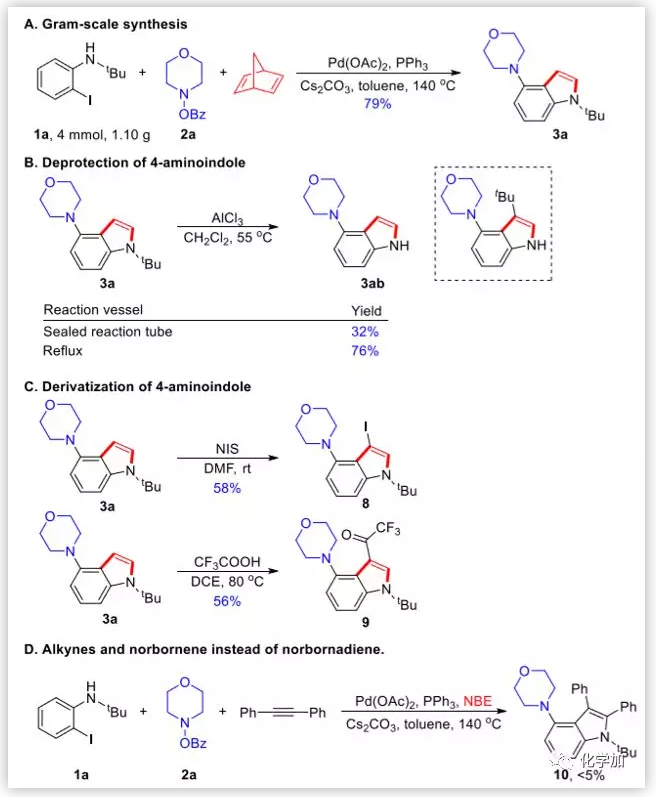
图6. 产物的衍生化(图片来源:J. Am. Chem. Soc.)
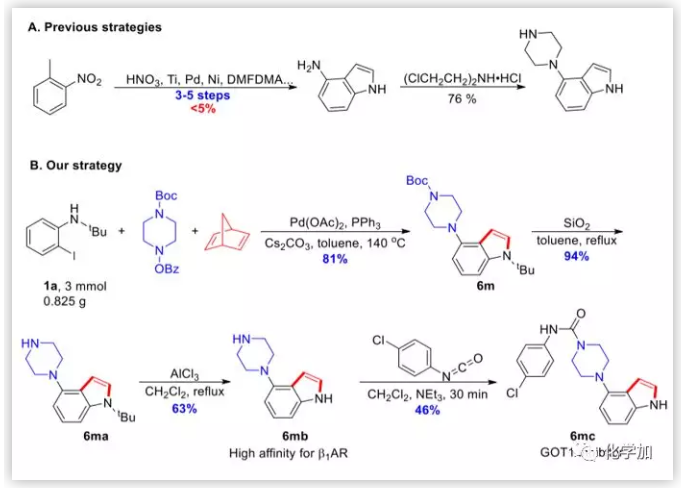
图7. 在药物合成中的应用(图片来源:J. Am. Chem. Soc.)
作者还通过DFT计算研究了带有不同保护基(Boc,t-Bu)的邻碘苯胺的反应机理。在整个机理研究中考虑了Cs2CO3的作用。在C-H活化之前,对于t-Bu中间体A,脱去CsI释放3.2 kcal/mol能量,形成B1;对于Boc中间体F,脱去CsI释放2.4 kcal/mol能量,形成G1。对于C-H活化过程,能垒分别为25.3和24.5 kcal/mol。可以旋转中间体B1和G1的苯环以获得中间体B2和G2。值得注意的是,由于叔丁基的大位阻,B2的能量比B1的能量大0.6 kcal/mol。这是当保护基为叔丁基时反应向邻位C-H活化方向进行的原因之一。
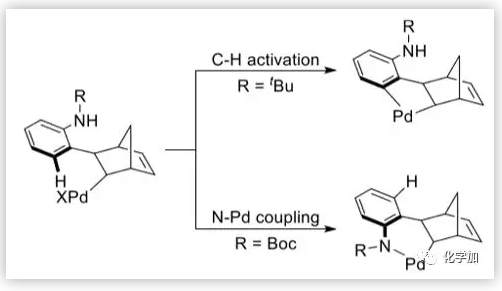
图8. C-H活化和Buchwald偶联(图片来源:J. Am. Chem. Soc.)
随后,作者研究了分子内C(sp3)-N Buchwald偶联的机理。对于中间体B2,碳酸根中的氧与叔丁基中的氢之间的距离为2.35 Å。因此,碳酸根和叔丁基之间的空间位阻阻止了Pd直接被氮原子进攻。根据碳酸根和胺之间的氢键以及Buchwald配体和钯的配位模式,作者推测苯与钯的配位可能导致碳酸根的羰基离去。结果是,碳酸盐可以通过16.1 kcal/mol的能垒从胺中除去质子,苯环可以与钯配位形成中间体D。然后发生1,3-Pd迁移获得中间体E。邻位胺化后,Buchwald偶联过程的能垒明显减小。
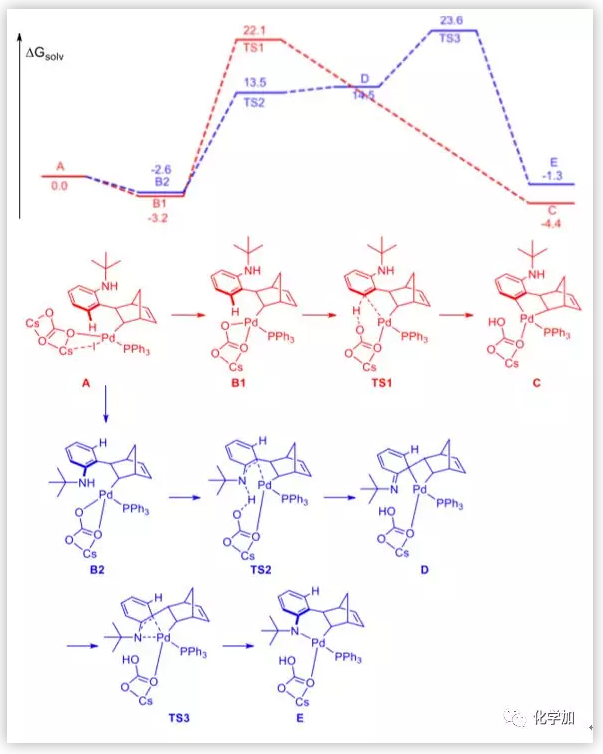
图9. DFT计算的吉布斯自由能图(叔丁基)(图片来源:J. Am. Chem. Soc.)
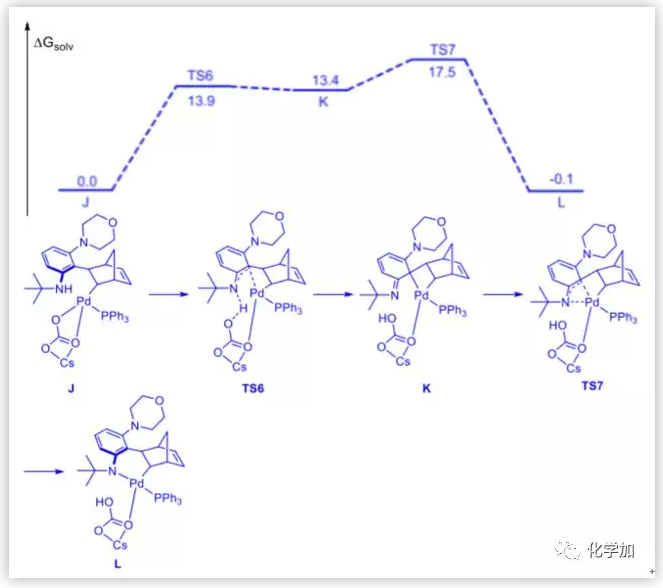
图10. 邻位胺化后的吉布斯自由能图(图片来源:J. Am. Chem. Soc.)
当保护基是Boc时,作者以相同的方式计算。但是没有形成类似于中间体D的去芳构化中间体。相反,直接形成中间体I。这可能是由于Boc和碳酸根之间的空间位阻很小。因此,作者推测这个过程是一个协同的金属化过程,然后找到了TS5。
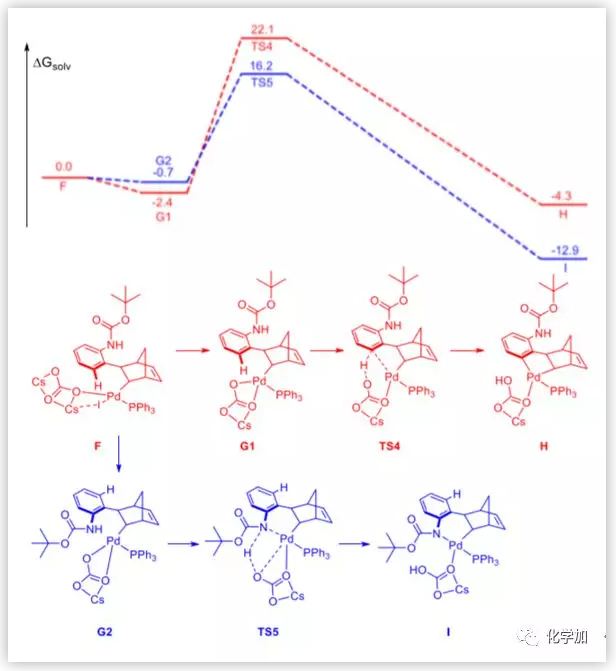
图11. DFT计算的吉布斯自由能图(Boc)(图片来源:J. Am. Chem. Soc.)
简而言之,当保护基是叔丁基时,Buchwald偶联的能垒比C-H活化的能垒大0.9 kcal/mol。当保护基是Boc时,Buchwald偶联的能量比C-H活化的能量低7.6 kcal/mol。计算结果与实验结果一致。
总结:通过Catellani和逆Diels-Alder策略,从邻碘苯胺、N-苯甲酰氧基胺和降冰片二烯出发,经三组分交叉偶联合成了高度官能化的4-氨基吲哚。基于DFT计算,该反应的分子内Buchwald偶联经历了去芳构化和1,3-钯迁移过程。反应条件温和、底物适用性广泛,还可以用于4-哌嗪基吲哚和GOT1抑制剂的合成。该方法在吲哚类生物碱和含4-氨基吲哚的药物分子合成中具有重要应用价值。该研究得到国家自然科学基金的大力支持,相关成果发表在Journal of the American Chemical Society 上。兰州大学的张博生博士和香港中文大学的李宇科博士是该论文的共同第一作者,梁永民教授为本文的通讯作者。
撰稿人:诗路化语
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn