

四氮唑和氢化异喹啉等含氮杂环化合物广泛存在于具有药理活性的化合物和农用化学品中(Fig.1a),因此开发新的合成各种含功能性基团的四氮唑和氢化异喹啉的方法一直是化学家们努力追求的目标。基于异氰化物的多组分反应(IMCRs)可将简单的起始原料通过“一锅法”转化为复杂的分子,具有较高的合成效率和原子经济性,因此该类多组分反应已成为合成杂环化合物的重要策略。但到目前为止,关于不对称合成高对映选择性的1,5-二取代四氮唑和1,2-二氢异喹啉的报道只有祝介平和王梅祥课题组共同开发的脂肪醛发生不对称Passerini型反应合成手性四氮唑化合物这一例。理论上,极性碳碳双键可以代替上述报道中的脂肪醛合成两性离子中间体I(Fig.1b)。因此,四川大学冯小明、刘小华团队报道了手性N,N'-二氧化物催化剂催化亚烷基丙二酸酯、异氰化物和TMSN3的多组分反应。通过准确控制参与反应的异氰化物的分子数量,作者能以中等至良好的收率和优良的对映选择性得到两种手性1,5-二取代四氮唑化合物。同时,作者利用两性离子中间体I作为1,3-偶极子与异喹啉发生不对称[3+2]环加成反应,可以得到1,2-二氢异喹啉化合物。
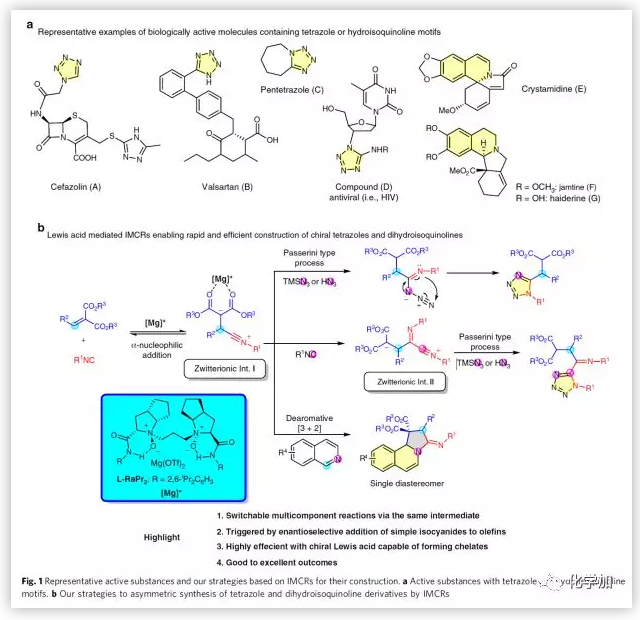
(图片来源:Nat. Commun.)
以2-萘基异氰化物1a、TMSN3 2a和二甲基2-(环己基亚甲基)丙二酸二甲酯3a为模板底物,作者对反应条件进行反复筛选,发现10 mol% Mg(OTf)2/L-RaPr2 (1.0/1.5)为催化剂,5 Å MS为添加物,CH2Cl2为溶剂,在−40 °C条件下反应2天,然后在−20 °C条件下反应3天,能以91%的收率和90%的对映选择性得到4a。若两分子的1a参与反应,在10 mol% Mg(OTf)2/L-RaPr2 (1.4/1.0)为催化剂,CH2ClCH2Cl 为溶剂,在30 °C条件下反应3 小时,能以91%的收率和89%的对映选择性得到5a (Table 1)。
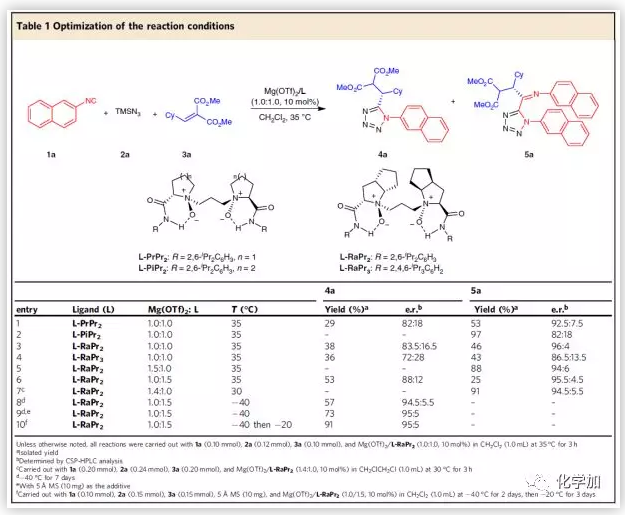
(图片来源:Nat. Commun.)
在最优条件下,作者考察了三组分反应的底物范围(Fig. 2)。二甲基、二乙基、二异丙基以及二苄基取代的丙二酸烷基烯能较好的适应反应条件,能以中等至良好的收率和对映选择性得到相应产物,但随着空间位阻的增大,其收率会随之降低。β-环烷基取代的丙二酸烷基烯的耐受性受环大小影响较大,七元环取代的底物只能以较低的收率和优秀的对映选择性得到相应产物,通过优化反应条件,收率会有所提高。对于其它环取代的底物,随着环大小逐渐降低,其收率和对映选择性会明显降低。β-异丁基取代以及其它支链或直链脂肪族取代的丙二酸烷基烯也具有良好的耐受性,能以中等至良好的收率和对映选择性得到相应产物。接下来,作者考察了异氰化物的底物范围。与2-萘基异氰化物相比,4-硝基苯基异氰化物能较好的适应反应条件,能以中等的收率和良好的对映选择性得到相应产物。紧接着,作者通过加入一定量的水使得芳香醛衍生丙二酸烷基烯也能适应反应条件。其中,对位取代丙二酸烷基烯的反应结果明显优于邻位和间位取代的反应结果。而萘环取代的丙二酸烷基烯以及(-)-香茅醛衍生的底物则表现出较低的收率和对映选择性。值得一提的是,加水不仅可以加快反应速度还可以抑制四组分的反应过程。
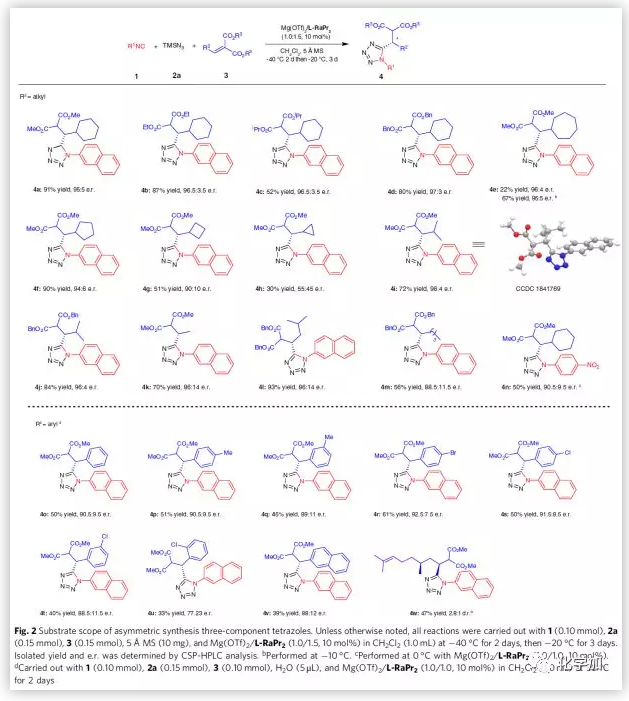
(图片来源:Nat. Commun.)
在最优反应条件下,作者考察了四组分反应过程的底物范围(Fig. 3)。β-位环状取代的丙二酸烷基烯的反应情况与三组分时反应情况相似,较小的环表现出较低的对映选择性。支链醛衍生的底物、酯基取代的丙二酸烷基烯、芳香醛衍生的底物以及萘基取代的丙二酸烷基烯均能较好的适应反应条件,能以中等至良好的收率和对映选择性得到相应产物。其中,电性因素对反应的影响与三组分时反应情况相似。在对异氰化物的底物范围进行考察时,作者发现电性因素对该反应影响很大。若用吸电子较强的4-NO2替代给电子取代基,则只能得到三组分反应产物。紧接着,作者对5e进行了衍生反应即在LiCl和H2O存在条件下,5e会脱去一个酯基。值得一提的是,即使在高温下,产物的酰亚胺部分也非常稳定。
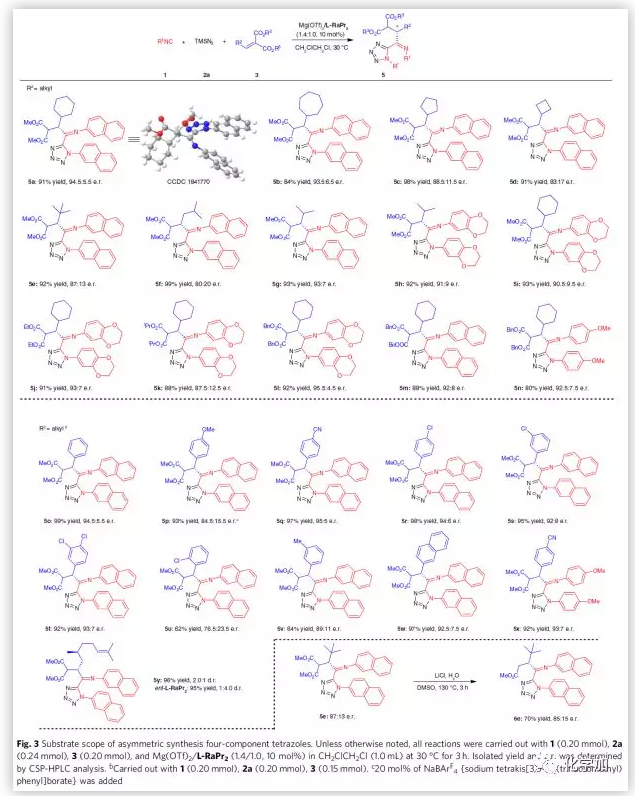
(图片来源:Nat. Commun.)
Fig.1b中提到的两性离子中间体I可作为1,3-偶极子参与反应,但到目前为止,应用中间体I发生环加成反应的报道屈指可数。因此,作者尝试了多种亲电试剂、异氰化物和偶极试剂,同时优化反应条件,发现以苯基取代的丙二酸烷基烯3o、异喹啉7a以及叔丁基异氰化物1e为模板底物,10 mol%Mg(OTf)2/L-RaPr2(1.2/1.0)为催化剂,CH2ClCH2Cl为溶剂,在35 ℃条件下反应2天,能以85%的收率和93%的对映选择性得到环加成产物8a。在该最优条件下,作者考察了1,2-二氢异喹啉的底物范围(Fig. 4)。各种酯基取代以及β-芳基取代的丙二酸烷基烯能较好的适应反应条件,能以良好收率和良好至优秀对映选择性得到相应产物。脂肪醛衍生的丙二酸烷基烯则表现出较低的收率和对映选择性。同时,各种取代的异喹啉也具有良好的耐受性。另一方面,异氰化物的空间位阻对反应的影响较大,空间位阻较大的1-金刚烷基异氰化物表现出优秀的对映选择性,而空间位阻较小的异氰化物则表现出较低的对映选择性。若用芳香族异氰化物替代叔丁基异氰化物,则该反应的对映选择性迅速降低。
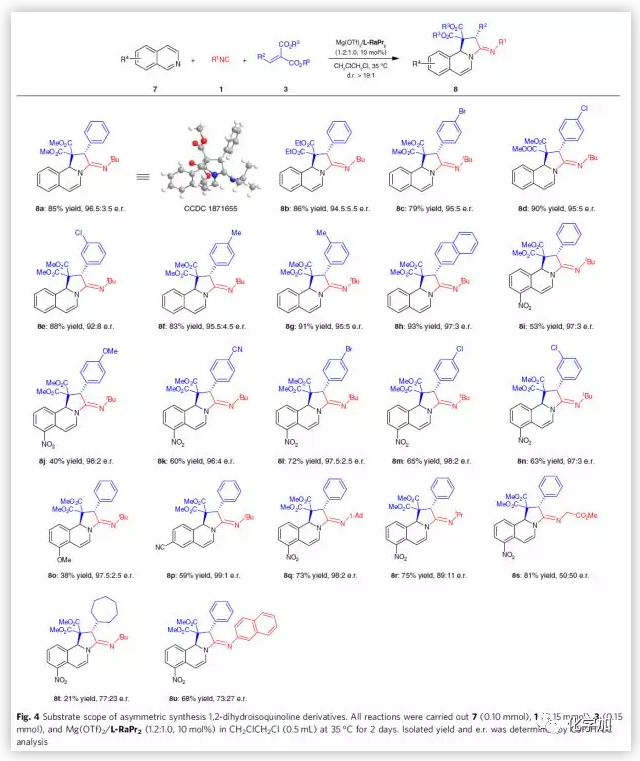
(图片来源:Nat. Commun.)
通过对照实验的数据以及文献报道,作者推测可能的机理(Fig. 5):首先,N,N'-二氧化物L-RaPr2、丙二酸烷基烯3a与MgII中心结合形成八面体复合物,由于空间位阻的影响,2-萘基异氰化物1a从Si面进攻得到中间体T1。在三组分反应过程中,T1会与HN3反应原位生成中间体T2,紧接着发生环化反应转化为中间体T3。最后,催化剂释放生成产物4a。而在四组分反应过程中,T1则会先与2-萘基异氰化物1a反应,生成两性离子中间体T4。最后,T4会与TMSN3或HN3反应得到四氮唑产物5a。值得一提的是,异氰化物的电性因素以及反应条件对该反应的进行起着决定性作用。
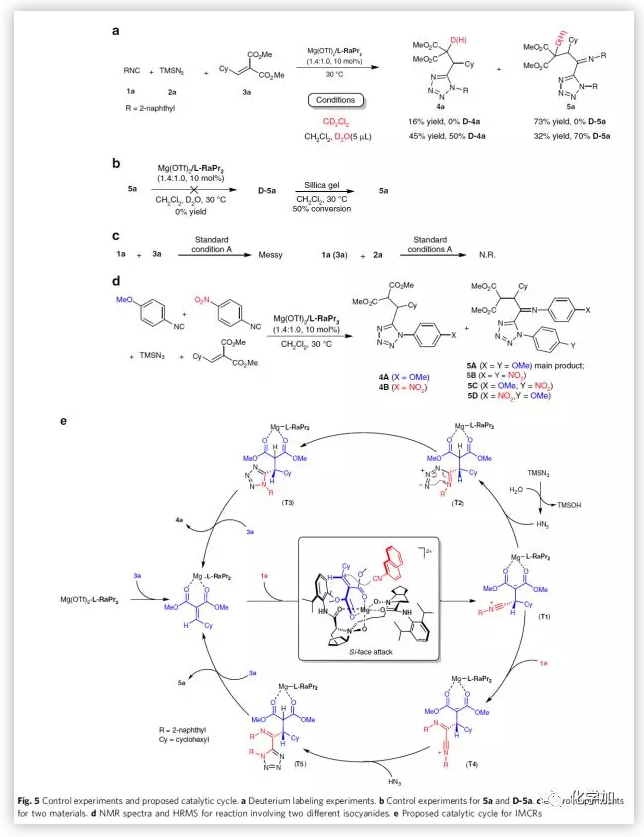
(图片来源:Nat. Commun.)
小结:四川大学冯小明、刘小华课题组报道了手性N,N'-二氧化物催化剂催化亚烷基丙二酸酯、异氰化物和TMSN3的多组分反应。通过准确控制参与反应的异氰化物的分子数量,作者能以中等至良好的收率和优良的对映选择性得到两种手性1,5-二取代四氮唑化合物。同时,作者利用两性离子中间体I作为1,3-偶极子与异喹啉发生不对称[3+2]环加成反应,可以得到1,2-二氢异喹啉化合物。
撰稿人:暖冬
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn