

(图片来源:J. Am. Chem. Soc.)
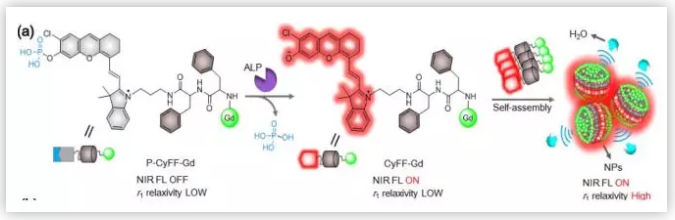
多模态分子成像探针对推进生物医学和临床研究至关重要;然而,将磁共振成像(MRI)和近红外(NIR)荧光协同结合的双型成像探针在恶性肿瘤的早期诊断中还没有得到满足。MRI可以生成组织穿透深度无限、空间分辨率高的解剖图像,促进术前对深部肿瘤的检测;NIR可以产生高灵敏度的图像,用于检测低浓度的肿瘤相关生物标志物和引导肿瘤手术。尽管已经报道了一些NIR/MRI双型探针,为分子成像和手术指导提供了高灵敏度和高空间分辨率,但是其中大多数探针没有与肿瘤细胞相互作用时也会响应。因此小分子探针能够在与肿瘤细胞相互作用时同时打开近红外荧光和MRI信号,其设计仍具有挑战性。目前还没有研究开发出基于小分子的探针,可以在自组装成纳米颗粒(NPs)后激活近红外荧光和MRI信号。
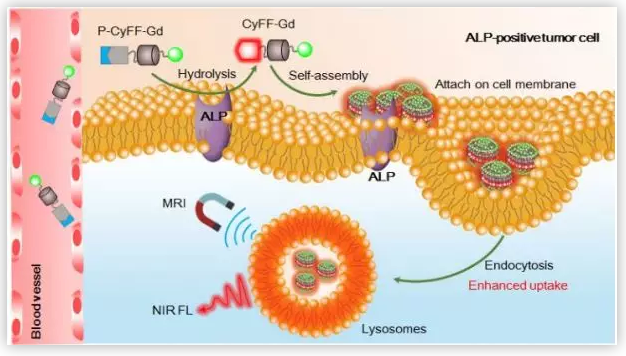
南京大学叶德举教授课题组设计并合成了基于小分子的可活化NIR/MRI双型探针,该探针通过酶促荧光反应和原位自组装策略用于体内成像。该策略利用了ALP的催化活性,这种酶通过持续的荧光反应和原位自组装促进了近红外荧光的放大,从而增强了MR特性和目标组织中的积累。结果表明,设计的可激活双型探针可以对皮下ALP阳性肿瘤进行无创、高灵敏度、空间分辨率的成像,并在近红外荧光引导下实时切除小鼠原位肝肿瘤。
(图片来源:J. Am. Chem. Soc.)
ALP激活的双型探针P-CyFF-Gd包含以下几个部分:用ALP识别的磷酸基团(-PO3H)预淬灭的近红外荧光团(Cy-Cl)、用于MRI的顺磁性螯合物DOTA-Gd和促进自组装的疏水性双肽Phe-Phe。在-PO3H 和DOTA-Gd存在的情况下,探针P-CyFF-Gd具有良好的水溶性,没有荧光并且容易分散到肿瘤部位。在肿瘤部位ALP作用下,P-CyFF-Gd脱去-PO3H形成CyFF-Gd并产生荧光(710 nm)。CyFF-Gd可以自组装成纳米颗粒。
(图片来源:J. Am. Chem. Soc.)
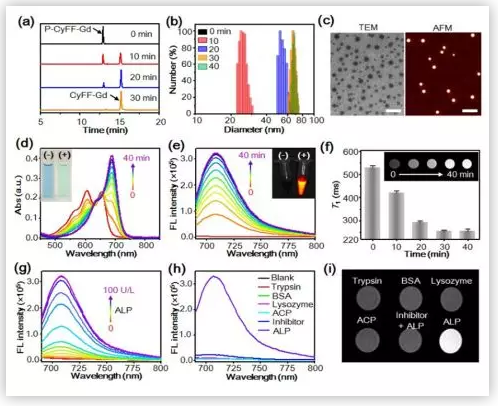
合成了探针P-CyFF-Gd之后,叶德举教授课题组在体外对探针的去磷酸化、自组装和NIR/MRI成像情况进行了研究。通过HPLC初步确定了P-CyFF-Gd在ALP的作用下去磷酸化形成CyFF-Gd。ALP作用前后,反应液紫外和荧光的变化进一步证明了ALP对探针P-CyFF-Gd的响应。动态光散射(DLS)和电镜证明了探针P-CyFF-Gd去磷酸化之后的自组装。
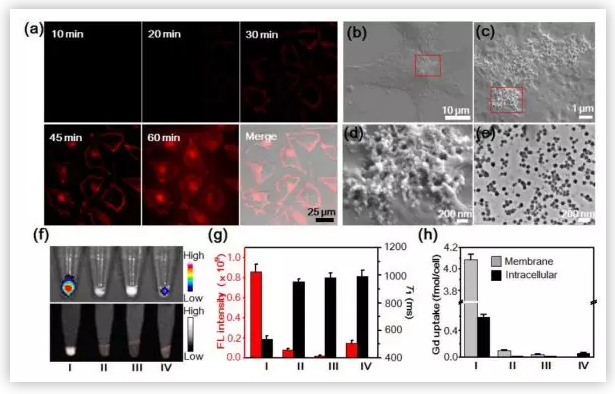
基于体外研究情况,叶德举教授课题组将探针P-CyFF-Gd用于活癌细胞的荧光/磁共振成像。实验结果与体外研究结果基本一致。
(图片来源:J. Am. Chem. Soc.)
为了阐明P-CyFF-Gd在体内成像的能力,叶德举教授课题组通过皮下注射P-CyFF-Gd,研究了ALP对活鼠NIR和MR的激活作用。结果表明,ALP介导的荧光反应和原位自组装能够有效地激活P-CyFF-Gd并增强探针在ALP相关肿瘤部位的聚集,从而实现了体内ALP相关肿瘤的高效荧光和MR双成像。
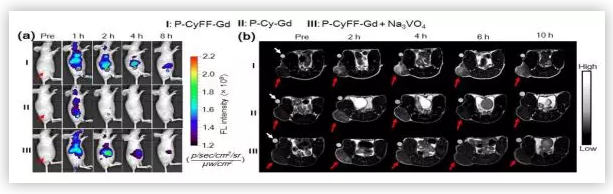
(图片来源:J. Am. Chem. Soc.)
考虑到ALP介导的荧光反应和原位自组装可促进活化纳米粒子(NPs)在肿瘤组织中的定位,叶德举教授课题组还将P-CyFF-Gd应用于原位HepG2肝肿瘤切除的可视化指导。术中小鼠生物发光成像证实肝肿瘤切除成功,有力证明P-CyFF-Gd是一种很有前途的指导原位肝肿瘤手术的分子成像工具。
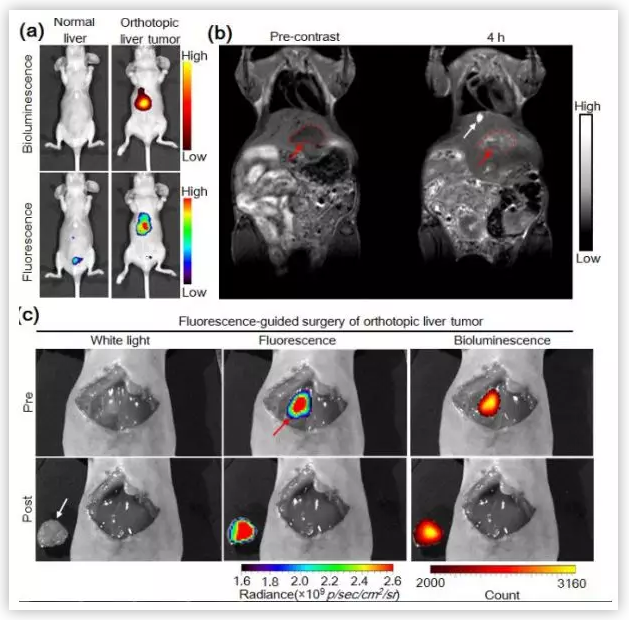
(图片来源:J. Am. Chem. Soc.)
总结:南京大学叶德举教授课题组报道了一种将酶介导的荧光反应与原位自组装相结合的新策略,并应用于设计一种基于小分子的可激活NIR/MRI双型探针P-CyFF-Gd,用于ALP活性的实时体内成像。P-CyFF-Gd可以被内源性过表达的ALP激活,产生膜定位的组装纳米粒子(NPs),同时增强近红外荧光(> 70倍,710 nm)和r1相对系数(约2.3倍),可以实时、高灵敏度、高空间分辨率成像和定位活肿瘤细胞和小鼠的ALP活性。P-CyFF-Gd还可以描绘原位肝肿瘤病灶,便于术中高效实时、图像引导的肿瘤组织切除。该策略将荧光反应激活的近红外荧光和原位自组装激活的MRI结合起来,促进ALP活性成像,可用于设计其他可激活的双型探针,实现实时成像酶活性和位置。这种策略还可以作为一种通用性的方法,用于构建其他生物标志物激活的NIR荧光/MRI双模态小分子影像探针,应用于疾病的诊断和影像引导的疾病治疗。
撰稿人:犟子柳
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn