

1. Pd-催化烯丙基醚的不对称烯丙基C-H烷基化反应
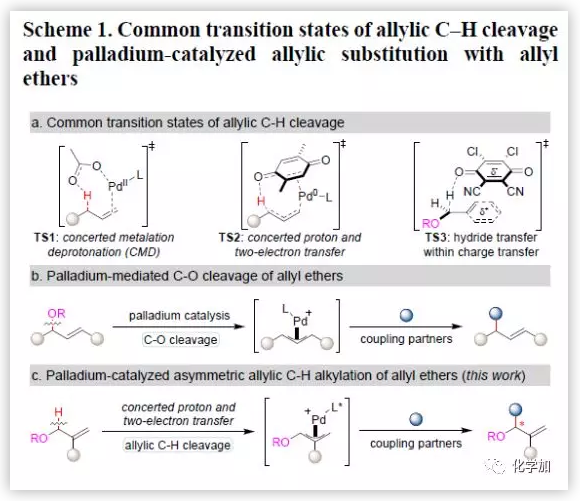
过渡金属Pd广泛用于末端烯烃的不对称烯丙基C-H烷基化反应,其中较为常见的机制是协同金属去质子化(Scheme 1a, TS1)。最近,Trost团队和中国科学技术大学龚流柱团队发现膦配体可以促进Pd-催化的不对称烯丙基C-H键官能团化反应。同时,通过实验和计算研究还发现该反应发生烯丙基C-H断裂过程涉及协同质子和双电子转移过程(Scheme 1a,TS2)。到目前为止,Pd-催化末端烯烃的不对称烯丙基C-H烷基化反应已经取得了很大的进展,但关于烯丙基醚的不对称C-H烷基化反应的报道还很少,主要是因为Pd-催化作用下,烯丙基醚易发生C-O键断裂形成的π-烯丙基-Pd中间体会发生Tsuji-Trost型烯丙基取代反应(Scheme 1b)。最近,Floreancig和刘鹏团队发现DDQ介导的烯丙基醚的氧化烯丙基C-H键断裂过程涉及电荷转移络合物发生氢转移过程(Scheme 1a, TS3),其中,TS2和TS3的醌都直接参与C-H键的断键。因此,中国科学技术大学龚流柱和汪普生团队设想烯丙基醚的C-H键断裂同样可以经历协同质子和双电子转移过程,生成的π-烯丙基-Pd中间体再与亲核试剂发生不对称烯丙基C-H烷基化反应(Scheme 1c)。
(图片来源:J. Am. Chem. Soc.)
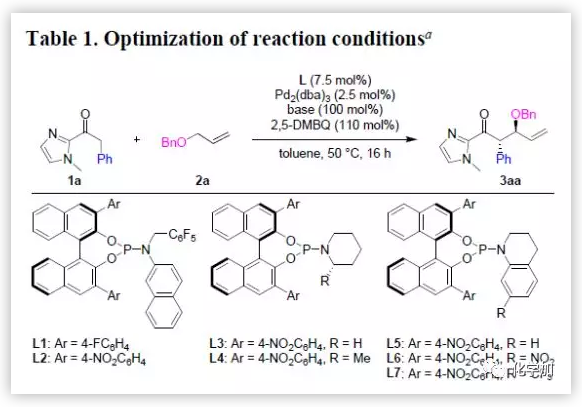
首先,作者以2-酰基咪唑1a和烯丙基苄基醚2a为模板底物,通过对催化剂和碱等反应条件反复筛选,确定最优条件(Table 1):2.5 mol% Pd2(dba)3和7.5 mol%手性亚膦酰胺配体L7为催化剂,100 mol%K2HPO4为碱,110 mol%2,5-DMBQ为氧化剂,甲苯为溶剂,在40 ℃条件下反应22 h,能以78%的收率和90%的对映选择性得到相应产物3aa。
(图片来源:J. Am. Chem. Soc.)
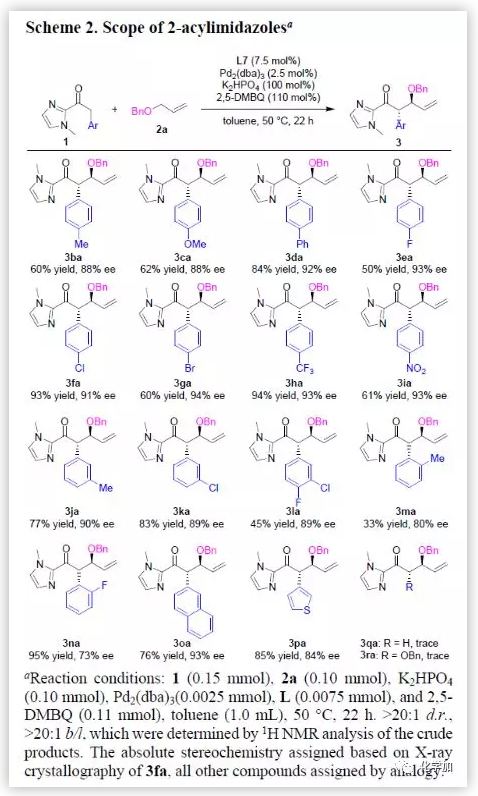
然后,在最优反应条件下,作者考察了2-酰基咪唑的底物范围(Scheme 2)。各种对位和间位芳基取代的2-酰基咪唑均能较好的适应反应条件,能以中等至优秀的产率和优秀的对映选择性得到相应产物。而邻位芳基取代的2-酰基咪唑则只能以中等的对映选择性得到相应产物。2-萘和3-噻吩取代的酰基咪唑同样具有良好的耐受性。若将R取代基换成氢或烷氧基,则该反应不能正常进行。
(图片来源:J. Am. Chem. Soc.)
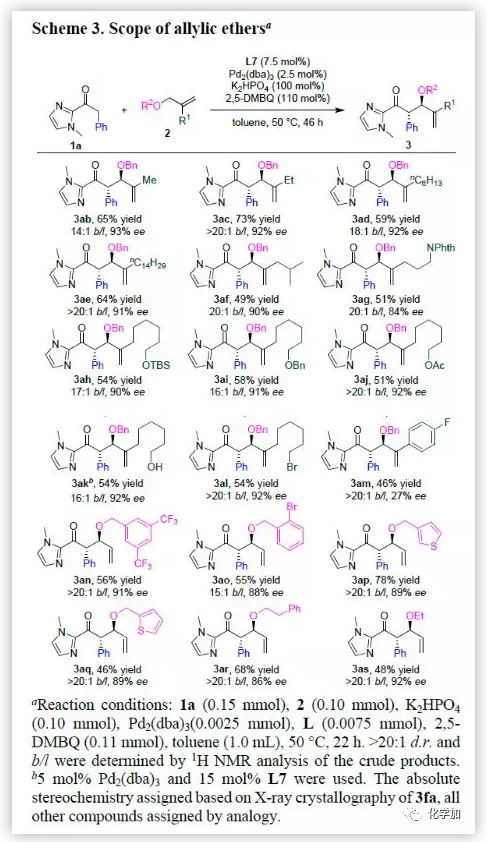
紧接着,作者对烯丙基苄基醚的底物范围进行了考察(Scheme 3)。各种1,1-二取代的烯烃、含酰胺、醚、酯和羟基等杂原子官能团的烯丙基苄基醚以及烷基溴取代的烯丙基苄基醚均具有良好的耐受性,能以中等至优秀的收率和优秀的对映选择性得到相应产物。若将R1换成芳基,由于共轭作用,该反应的对映选择性明显降低。此外,将烯丙基苄基醚的苄基部分换成各种取代的芳基以及各种杂环,该反应能较好的进行,能以中等的收率和良好至优秀的对映选择性得到相应产物。
(图片来源:J. Am. Chem. Soc.)
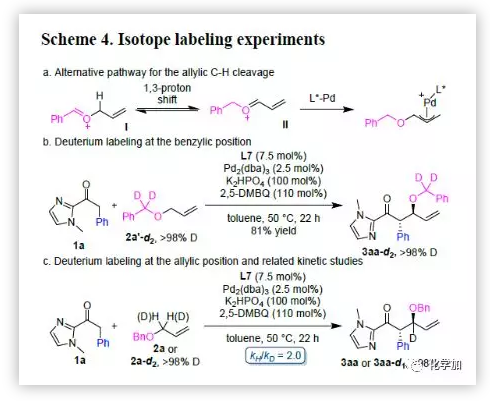
为了进一步了解反应机理,作者进行了氘代实验(Scheme 4)。2-酰基咪唑1a和烯丙基氘代苄基醚2a'-d2反应,能以81%的收率和> 98%的对映选择性得到产物3aa-d2。1a和氘代烯丙基苄基醚2a-d2反应可以生成3aa-d1且烯丙基位置的氘代率> 98%。另外,该反应表现出不可忽略的动力学同位素效应(KIE,kH/kD = 2.0)。这些结果与烯丙型C-H键断裂/官能团化机制保持一致。同时,这些结果显示烯丙基C-H断裂过程可能是该反应的关键步骤。
(图片来源:J. Am. Chem. Soc.)
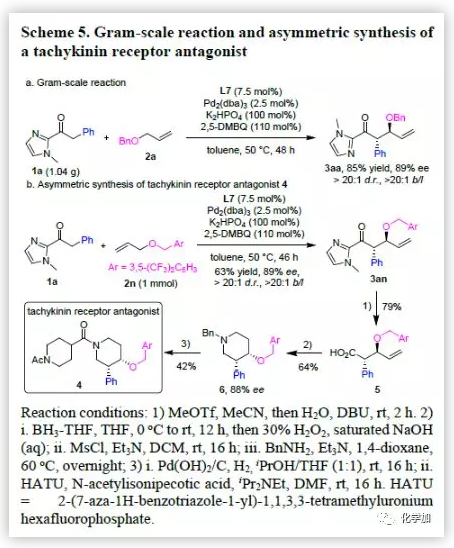
为了证明该反应的应用潜力,作者进行了克级规模反应和衍生反应(Scheme 5)。克级规模反应的收率有所提高且对映选择性不变,这为扩大化生产提供了依据。此外,产物3an在MeOTf的乙腈溶液中反应一段时间后,加入DBU和H2O可以79%的收率得到手性γ-烷基羧酸5。5和BH3-THF反应的产物经H2O2/NaOH氧化可生成手性二醇。手性二醇发生甲磺酰化反应的产物与苄胺反应,能以64%的收率得到哌啶6。最后,Pd(OH)2/C选择性脱去6的N-苄基保护基,生成的产物在HATU的作用下可与N-乙酰基哌啶甲酸发生酰胺偶联反应,能以42%的收率得到速激肽受体拮抗剂4。
(图片来源:J. Am. Chem. Soc.)
2. Cu-/NHC共催化靛红衍生的烯醛的不对称环加成反应
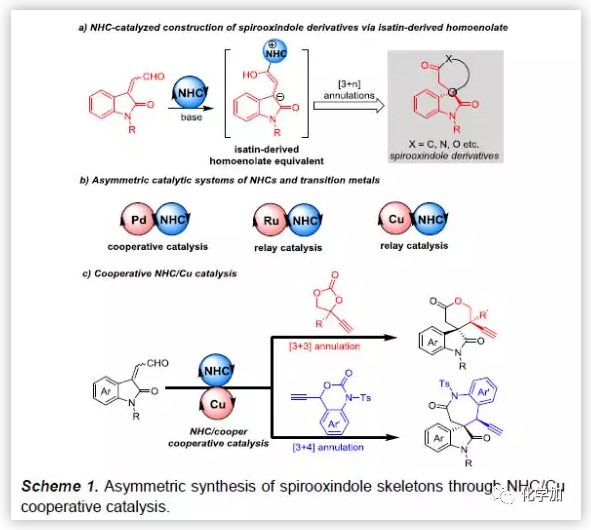
3,3'-螺环氧化吲哚结构广泛存在于天然产物和具有药理活性的化合物中,因此,该类化合物的合成引起化学家们的广泛关注,但该类化合物的合成仍然面临巨大挑战。NHC催化可通过极性反转策略实现复杂分子的合成,是有机合成中强有力的合成策略之一。2016年,Enders课题组成功的实现了NHC催化靛红衍生的烯醛的不对称[3+4]环加成反应,可以合成一系列高对映选择性的螺环吲哚化合物(Scheme 1a)。随后,出现了许多类似的NHC催化的不对称[3+n]环加成反应用于构建螺环吲哚化合物的报道。
金属和NHC协同催化可极大地丰富NHC催化体系,但NHC作为配体与过渡金属之间的强相互作用易导致其中一种或两种催化剂失活。随着时代的发展,目前已经有一些课题组找到了解决方法,并报道了一些关于Pd-/NHC,Ru-/NHC或Cu-/NHC共催化的不对称反应(Scheme 1b)。最近,Cu-催化的经历Cu-烯丙二烯中间体的不对称炔丙基取代反应取得了重大的进展。此外,乙炔基乙烯碳酸酯和乙炔基苯并噁嗪酮发生脱羧反应生成的亲核试剂/Cu-烯丙二烯双功能中间体可进一步发生不对称环化反应。受到上述Cu-/ Lewis碱共催化的成功报道的启发,中国科学技术大学龚流柱和宋琎团队开发了Cu-/NHC共催化靛红衍生的烯醛与乙炔基乙烯碳酸酯或乙炔基苯并噁嗪酮不对称环化反应,合成了一系列螺环氧化吲哚化合物(Scheme 1c)。
(图片来源:Angew. Chem. Int. Ed.)
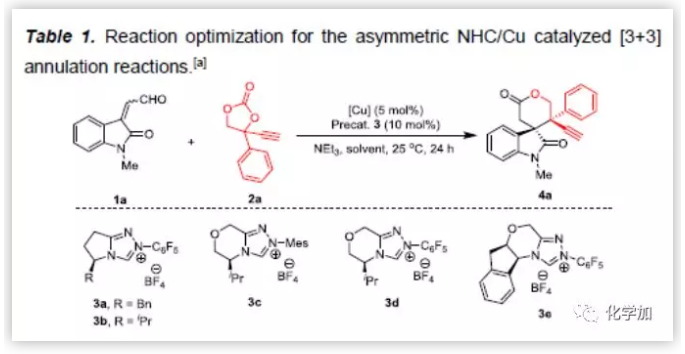
首先,作者以靛红衍生的烯醛1a和乙炔基乙烯碳酸酯2a为模板底物,通过对催化剂、溶剂、温度等反应条件的反复筛选,确定最优反应条件(Table 1):5 mol%Cu(CH3CN)4PF6和NHC催化剂3d为共催化剂,1 equiv NEt3为碱,PhF为溶剂,在10 ℃条件下反应36 h,能以75%的收率、99%的对映选择性以及>95:5的非对映选择性得到相应产物。
(图片来源:Angew. Chem. Int. Ed.)
在最优反应条件下,作者对该反应的底物范围进行了考察(Table 2)。各种N-Me、N-Et、N-Bn、N-Ph取代以及各种5-,6-和7-位芳基取代的靛红衍生的烯醛均能较好的适应反应条件,能以中等至良好的收率、优秀的对映选择性和非对映选择性得到相应产物。同时,各种对位或间位取代以及2-萘基取代的乙炔基乙烯碳酸酯具有良好的耐受性,能以中等良好的收率、优秀的对映选择性和非对映选择性得到相应产物。其中,4a的绝对构型通过单晶确定。
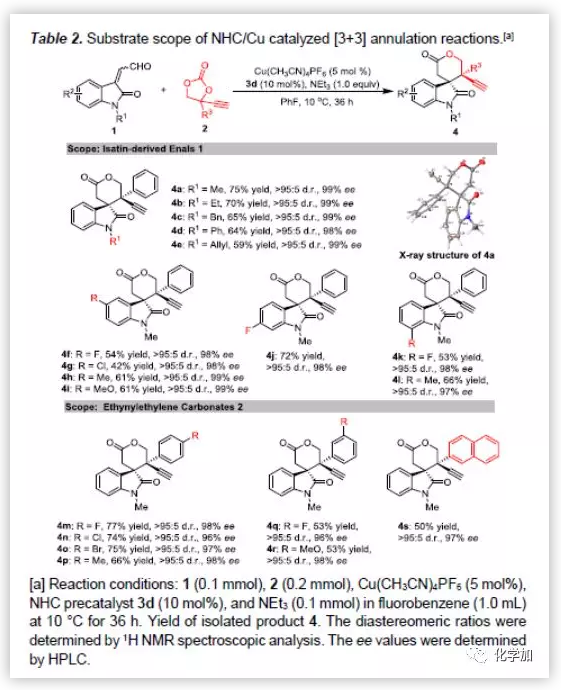
(图片来源:Angew. Chem. Int. Ed.)
此外,NHC/Cu-共催化体系可用于靛红衍生的烯醛与乙炔基苯并噁嗪酮的不对称[3+4]环加成反应,构建螺苯并氮杂卓酮骨架。作者对该反应条件进行了简单的筛选,确定了最优反应条件。然后,作者在最优反应条件下对反应的底物范围进行了考察(Table 3)。各种N-取代的靛红衍生的烯醛均能较好的适应反应条件,能以良好至优秀的收率和对映选择性得到相应产物,但其非对映选择性不太好。同时,各种芳环取代的靛红衍生的烯醛具有良好的耐受性,能以良好至优秀的收率、优秀的对映选择性和良好的非对映选择性得到相应产物。此外,各种乙炔基苯并噁嗪酮均能较好的适应反应条件,能以良好的收率和优秀的立体选择性得到相应产物。其中,6a的绝对构型通过单晶确定。
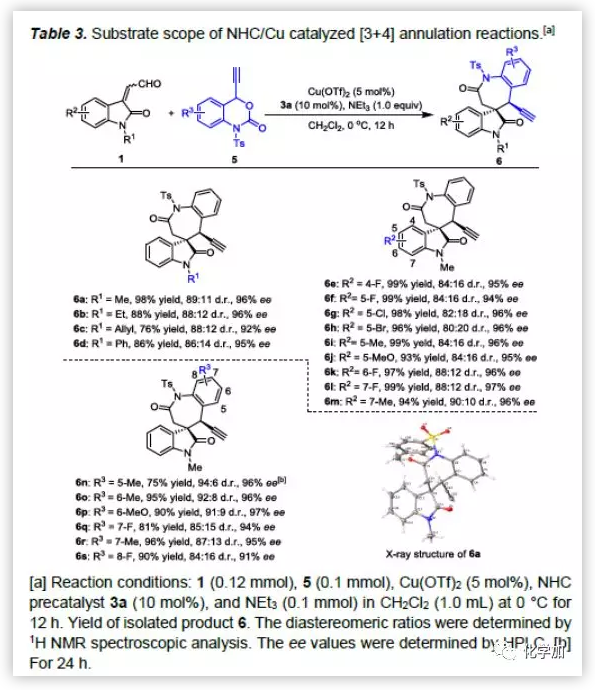
(图片来源:Angew. Chem. Int. Ed.)
根据上述实验结果,作者推测可能的机理(Figure 1):碱性条件下,Cu(CH3CN)4PF6 和NHC催化剂3d生成的CuI/NHC-3d络合物会与2a的炔基相连生成中间体I。I依次发生质子化反应和脱羧反应,生成Cu-烯丙二烯中间体III(或III')。同时,NHC-3d与烯醛1a反应生成的NHC-烯醇化物IV会与III反应生成中间体VI。最后,VI依次发生O-酰化环化反应和质子化反应生成产物4a,同时催化剂再生。[3+4]环加成反应同样经历相同的反应过程:5a发生不对称偶联反应生成的Cu-烯丙二烯中间体VIII与烯醇化物V反应生成中间体IX(Figure 2)。然后,IX依次发生O-酰化环化反应和质子化反应生成产物6a,同时催化剂再生。
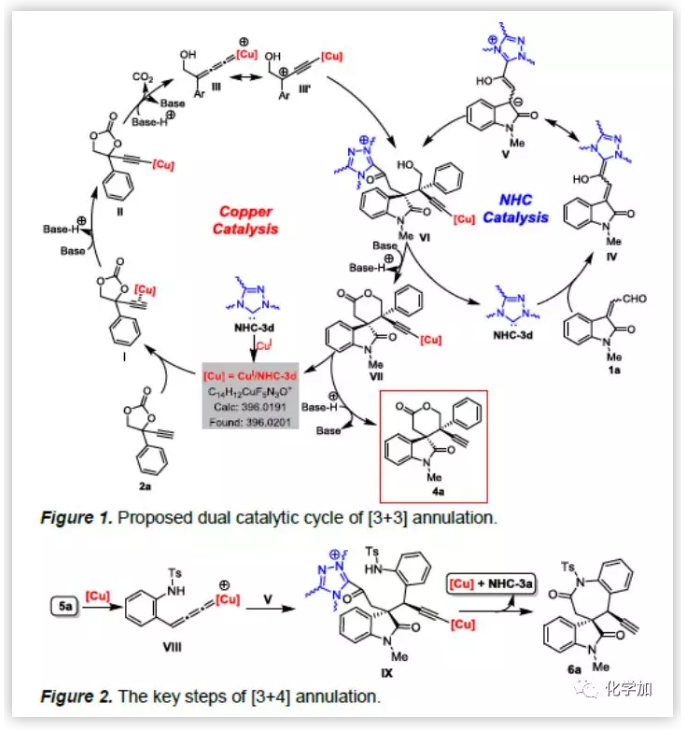
(图片来源:Angew. Chem. Int. Ed.)
小结:中国科学技术大学龚流柱和汪普生团队报道了Pd-催化烯丙基醚的不对称烯丙基C-H烷基化反应,能以中等至优秀的收率和优秀的对映选择性得到一系列官能团化的手性2-酰基咪唑类化合物。同时,得到的产物可用于速激肽受体拮抗剂的合成。此外,中国科学技术大学龚流柱和宋琎团队开发了Cu-/NHC共催化靛红衍生的烯醛与乙炔基乙烯碳酸酯或乙炔基苯并噁嗪酮不对称[3+3]或[3+4]环化反应,能以良好的收率和优秀的对映选择性得到一系列螺环氧化吲哚化合物。
撰稿人:暖冬
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn