

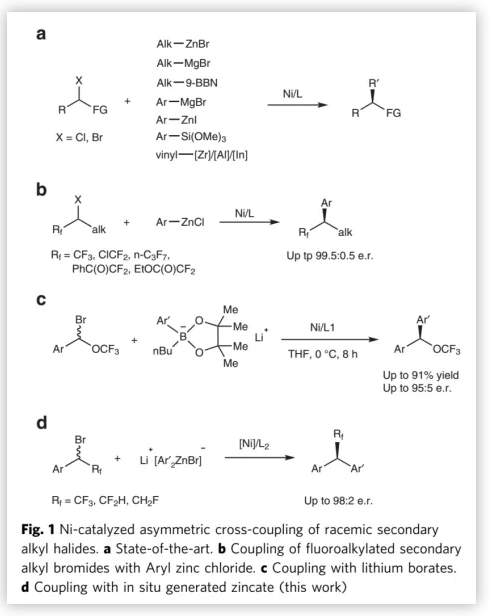
镍催化仲烷基卤化物与亲核试剂的不对称交叉偶联反应可广泛用于合成含叔碳手性中心的化合物。相对应用广泛的仲烷基卤化物来说,镍催化的不对称交叉偶联反应中的亲核试剂主要局限于烷基/芳基卤化锌、烷基-9-硼双环(3,3,1)-壬烷、芳基格氏试剂、芳基/乙烯基硅酸盐、乙烯基/炔基铟/锆/铝试剂(Fig. 1a)。
有机硼试剂可有效的用于C-C键和C-N键的合成。早在2004年就有关于镍催化仲烷基溴化物与芳基硼酸的消旋的偶联反应,但芳基硼酸发生金属转移反应生成活泼的镍中间体这个过程非常缓慢,只有在60 ℃条件下才能完全转换。为了促进转金属化过程,G. C. Fu课题组以烷基-9-硼双环(3,3,1)-壬烷为亲核试剂,发现反应在5 ℃条件下就可以以优秀的对映选择性得到产物。但烷基硼烷通常对空气和湿气敏感,因此反应中只能使用原位发生硼氢化反应生成烷基硼烷,这极大地限制了该底物的应用(Fig. 1b)。
2017年,中国科学院上海有机化学研究所沈其龙团队发现镍催化CF3O取代的仲苄基溴化物与有机硼酸锂的不对称Suzuki-Miyaura偶联反应中的转金属化过程比芳基硼酸用作亲核试剂的转金属化过程快很多,且能以优秀对映选择性得到偶联产物(Fig. 1c)。考虑到氟烷基在新药开发的选择性和药代动力学中的重要作用,作者利用[Ph2ZnBr]Li作为亲核试剂加快转金属化过程,实现氟烷基仲苄基溴化物的不对称交叉偶联反应,能以高对映选择性得到具有光学活性的二苯甲基氟代烷烃衍生物(Fig. 1d)。
(图片来源:Nat. Commun.)
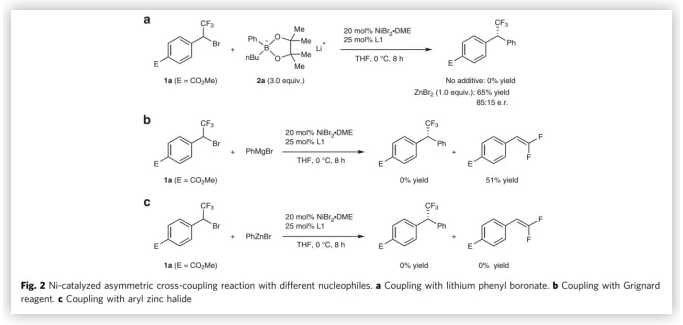
作者以三氟甲基溴苄1a和有机硼酸锂2a在20 mol%NiBr2•DME和25 mol%L1为催化剂,THF为溶剂,在0 ℃反应8 h,发现无产物生成。在相同的反应条件下,加入1 equiv ZnBr2作为添加剂,则该反应能以65%的收率和70%的对映选择性得到偶联产物(Fig. 2a)。若将亲核试剂换成格氏试剂如PhMgBr,则该反应只能以51%的收率得到脱氟的副产物。若将PhMgBr换成PhZnBr,则不能观察到产物的生成(Fig. 2b, c)。
(图片来源:Nat. Commun.)
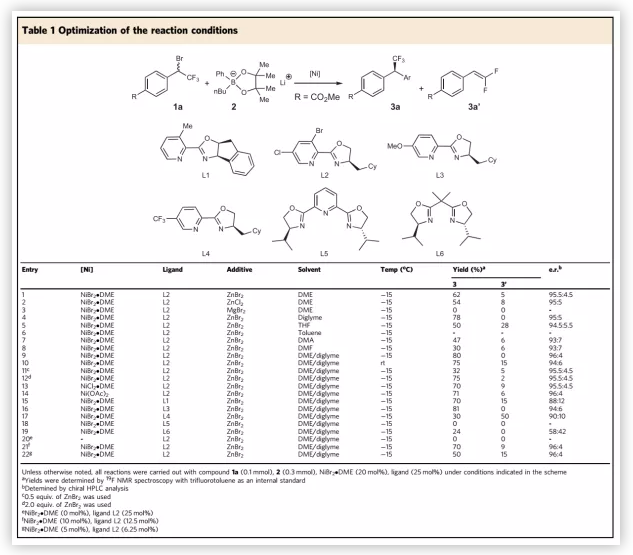
确定了模板底物后,作者通过对催化剂、溶剂、温度等反应条件进行筛选,确定最优的反应条件(Table 1):20 mol% NiBr2•DME和25 mol%配体L2为催化剂,1 equiv ZnBr2作为添加剂,乙二醇二甲醚/二甘醇二甲醚 (体积比为1:1)为溶剂,在-15 ℃条件下反应12 h,能以77%的收率和92%的对映选择性得到相应产物。
(图片来源:Nat. Commun.)
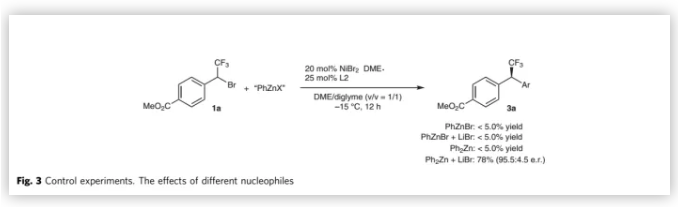
理论上,芳基硼酸锂与ZnBr2的混合液可能会产生几种不同的芳基锌中间体,从而加速转金属化过程和整个反应。为了探究哪种芳基锌中间体参与反应,作者进行了控制实验(Fig.3)。标准条件下,不论是否加入3 equiv 的LiBr,化合物1a与PhZnBr均只能以<5%的收率得到偶联产物。这个结果排除了PhZnBr和Ph2Zn参与反应的可能性。有趣的是,在1a与Ph2Zn的反应中加入3.0 equiv LiBr可以78%的收率和91%的对映选择性得到偶联产物。该结果显示[Ph2ZnBr]-可能参与反应。
(图片来源:Nat. Commun.)
为了进一步证明[Ph2ZnBr]-参与反应,作者对芳基硼酸锂和ZnBr2混合液的碳谱与Ph2Zn和LiBr混合液的碳谱进行了研究和对比(Fig. 4)。等当量的LiBr和Ph2Zn在THF-d8溶液中室温反应0.5 h,13C NMR中可观察到161.0 ppm处有一明显的峰出现,说明该反应中有[Ph2ZnBr]Li生成。等当量的苯基硼酸锂2a与ZnBr2在相同条件下反应0.5 h也能观察到同样的现象。这说明[Ph2ZnBr]Li可以促进金属转移步骤,从而加速反应的催化速度。但是,作者无法排除另一种途径,即ZnBr2会与镍溴化苄络合物反应生成η3-苄基镍中间体,该中间体可以更快的与有机硼酸锂2a发生转金属化反应。
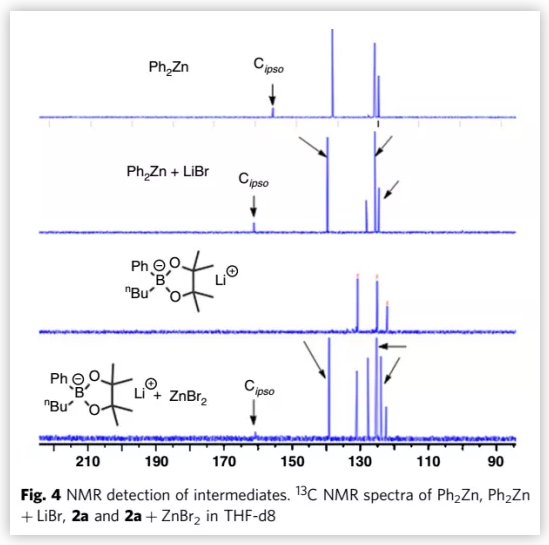
(图片来源:Nat. Commun.)
在最优反应条件下,作者对三氟甲基溴苄的底物范围进行了考察(Fig. 5)。各种酯基、氰基、硝基,三氟甲基、三氟甲氧基以及各种卤原子等吸电子取代的三氟甲基溴苄均能较好的适应反应条件,能以中等至良好的收率和优秀的对映选择性得到相应产物。但给电子取代的三氟甲基溴苄的反应收率降低了很多,可观察到自身偶联和脱氟副产物的生成,且只能以中等的收率得到相应产物。紧接着,作者对芳基硼酸锂的底物范围进行了考察。间位芳基取代的芳基硼酸锂具有良好的耐受性,能以良好的收率和对映选择性得到相应产物。对甲基或对氟芳基取代的芳基硼酸锂则只能以中等的收率和对映选择性得到相应产物。但邻甲基取代的芳基硼酸锂不能得到相应的偶联产物。
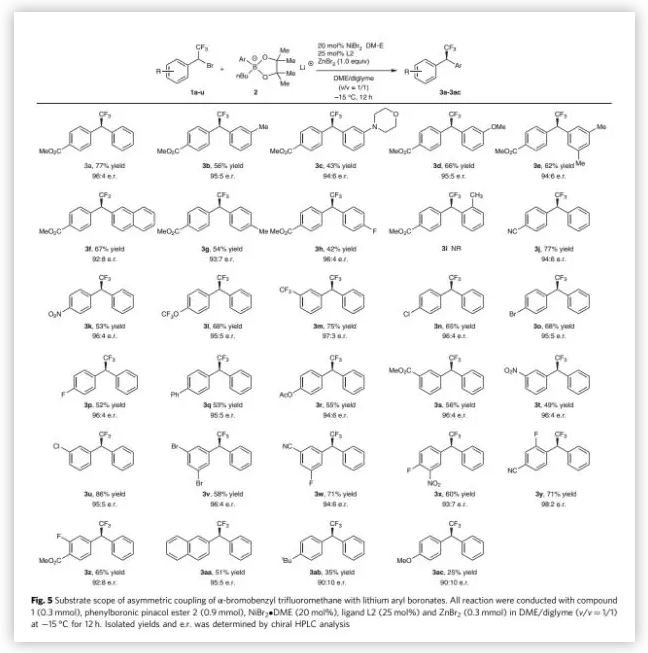
(图片来源:Nat. Commun.)
受到上述良好结果的鼓舞,作者考察了其它氟代烷基溴化苄的反应情况。经过简单的条件筛选,作者发现使用空间位阻更大的L7作为配体,同时将反应温度降至-40 ℃,可以良好的对映选择性得到相应产物(Fig. 6)。例如,例如,4-(1-溴- 2,2-二氟乙基) -3-氟苄腈、苯基硼酸锂2a和4-氟苯基硼酸锂2h在上述最优反应条件下反应,能以88%的对映选择性得到相应产物。另一方面,单氟烷基溴化苄的偶联反应更具挑战性。经过简单的条件筛选,4-(1-溴-2-氟乙基)芳烃与苯基硼酸锂2a以NiBr2•DME与配体L8为催化剂,在-10 ℃下反应12 h,能以中等的对映选择性得到相应产物。
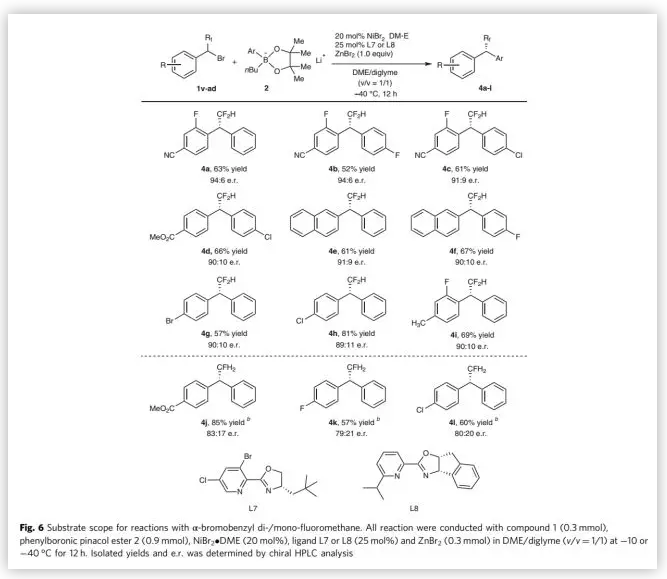
(图片来源:Nat. Commun.)
为了证明反应的应用潜力,作者进行了衍生反应(Fig. 7)。产物经过4步转化,可以55%的收率和88%的对映选择性得到组蛋白赖氨酸(EZH2)抑制剂类似物;同时,可以71%的收率和80%的对映选择性得到组胺H3受体类似物。
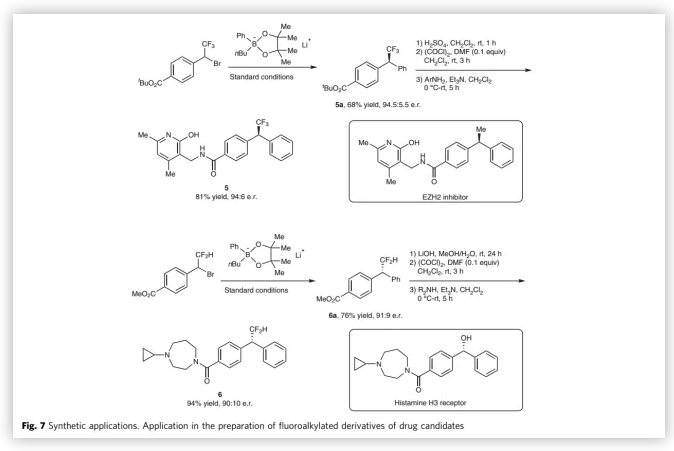
(图片来源:Nat. Commun.)
总结:中国科学院上海有机化学研究所沈其龙团队利用[Ph2ZnBr]Li作为亲核试剂加快转金属化过程,实现氟烷基仲苄基溴化物的不对称交叉偶联反应,能以高对映选择性得到具有光学活性的二苯甲基氟代烷烃衍生物。同时,通过简单的衍生反应,作者可以合成组蛋白赖氨酸(EZH2)抑制剂类似物和组胺H3受体类似物。
撰稿人:暖冬
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn