

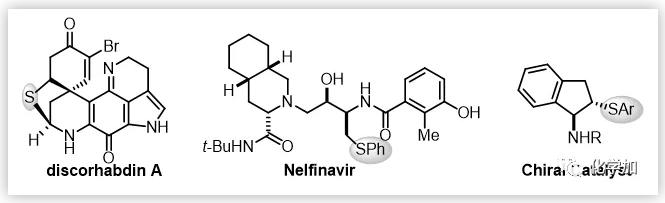
手性硫化合物广泛存在于活性天然产物和药物分子中,在不对称催化中也扮演着重要角色;同时它们也是一类很重要的合成中间体,被广泛用于天然产物及药物的合成中(图1)。目前关于手性硫化合物的不对称合成方法主要集中在硫亲核加成,硫叶立德的2,3-重排,亲电性的硫醚化反应。其中,烯烃的不对称催化硫醚化反应是合成这类化合物最直接有效的方法。
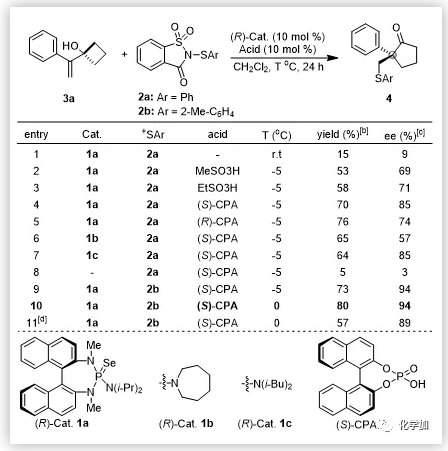
在过去的十几年中,Denmark课题组使用手性路易斯碱和非手性布朗斯特酸实现了烯烃的硫醚化反应;史一安课题组使用手性布朗斯特酸同样实现了该类反应。尽管如此,由于反应以及底物类型的局限性,手性硫化合物的合成方法仍然是很有限的。例如,由于1,1-二取代和三取代烯烃底物反应过程中的面选择性较难控制,使得这两种底物在不对称硫醚化反应中只能得到很低的对映选择性。但由于该类底物能够快速构建具有手性季碳中心的分子结构单元,且它们普遍存在于药物和天然产物中。因此,很有必要去实现该类底物的高对映选择性反应。
近日,上海交通大学涂永强院士和陈志敏特别研究员设计以1,1-二取代烯丙醇为底物,利用手性的路易斯碱/布朗斯特酸共催化体系首次实现了1,1-二取代或三取代烯烃的不对称Sulfenylation/Semipinacal重排反应,最终构建了一系列含有手性季碳中心的β-硫芳基酮化合物并将其用于天然产物(-)-herbertene的高效合成。
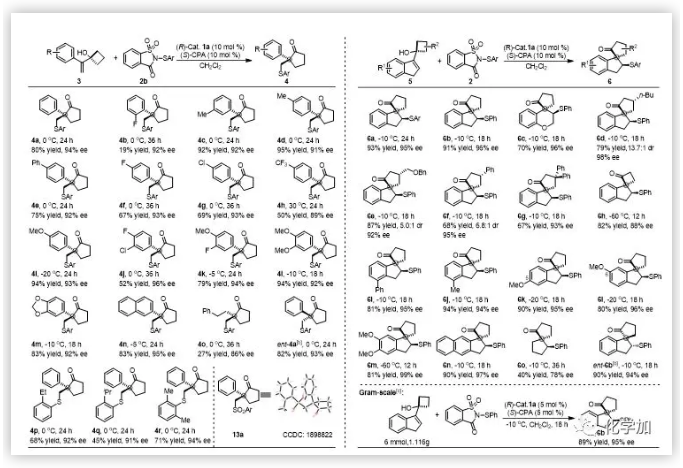
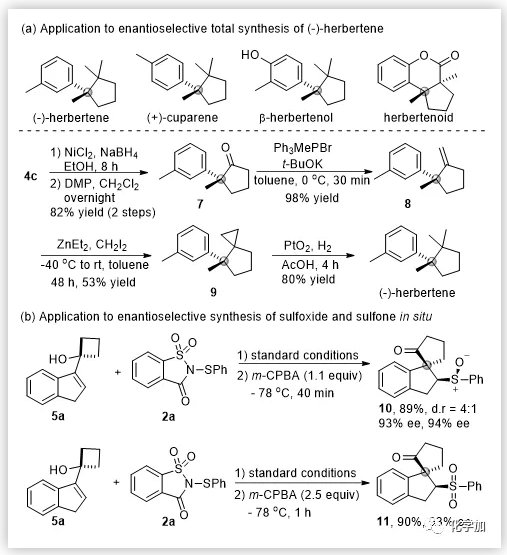
随后,作者对反应的实用性进行了研究。β-硫芳基酮产物通过简单的几步转化就可以合成天然产物(-)-herbertene(图4)。此外,通过原位加入氧化剂,作者也以优异的产率和优异的对映选择性实现了一锅法手性亚砜和砜的合成。
基于之前的工作,作者认为向该催化体系中加入(S)-CPA后先形成了活性中间体物种12a。作者通过低温31P -NMR实验,验证以上的猜想。为了进一步理解反应的对映选择性的控制过程和手性Brønsted酸的作用,作者还与苏州大学鲍晓光课题组合作进行了计算研究(图5,6)。
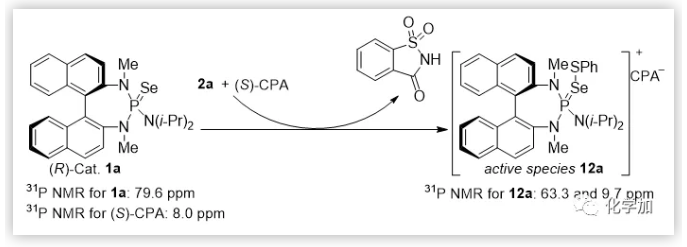
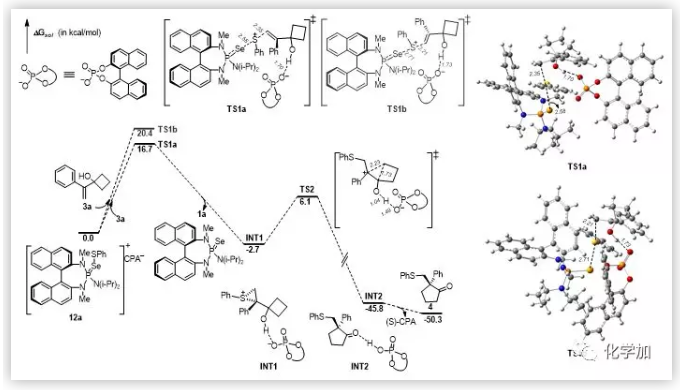
总结:上海交通大学涂永强院士和陈志敏特别研究员使用手性路易斯碱和布朗斯特酸作为共催化剂,首次成功地实现了1,1-二取代和三取代烯丙醇的对映选择性Sulfenylation/Semipinacal重排反应。该方法提供了一种有效,直接和容易合成β-硫芳基酮的途径。此外,高效合成天然产物(-)-herbertene和一锅法合成手性亚砜和砜证明了该方法的合成有用性。克级规模实验的成功表明对映选择性亚磺酰化反应可转化为制备规模。计算研究结果进一步证明了手性路易斯碱和布朗斯特酸的共催化作用。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn