

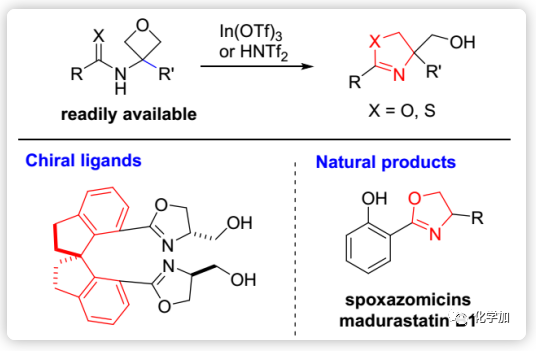
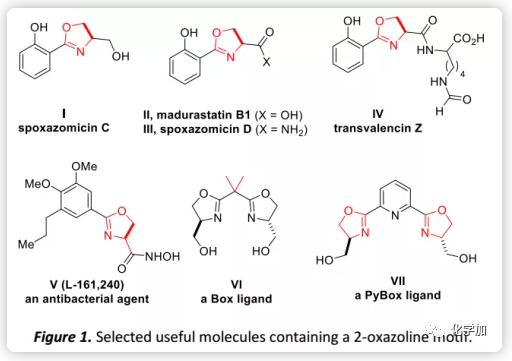
2-噁唑啉不仅广泛存在于许多天然产物和生物活性分子(如化合物I-V,Figure 1)的杂环亚结构和药效团,还是有机合成中的通用官能团如基于噁唑啉的配体Box和PyBox(VI-VII)。此外,噁唑啉还常用作保护基、导向基团和合成辅基。基于其广泛的应用,开发有效的噁唑啉合成方法一直是有机合成的重要课题。目前,通过β-羟基或不饱和酰胺的环化合成噁唑啉是最直接和最常用的方法(Scheme 1a),然而其通常会涉及剧烈条件或腐蚀性试剂(如DAST和氧化剂)的使用,不可避免地导致成本增加或化学废物产生。因此,开发温和的催化方法意义重大。
(图片来源:Chem. Sci.)
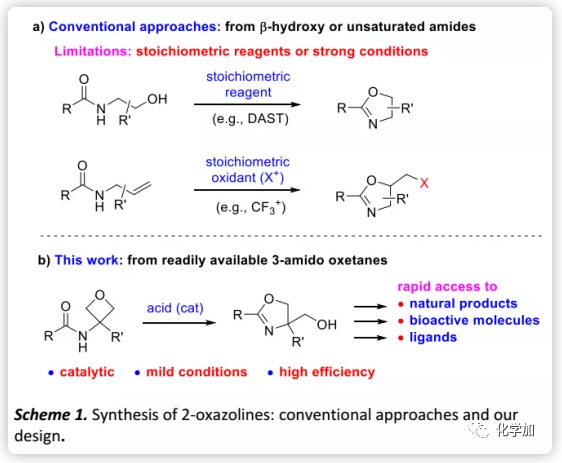
氧杂环丁烷是药物化学和有机合成中常见的结构片段,与其三元环同系物(环氧乙烷)相比,其合成能力尚未得到充分研究。近日,香港科技大学孙建伟团队开发了一种新的温和催化方法用于从氧杂环丁烷合成噁唑啉,从而能够快速获得多种天然产物。
作者设想含有3-酰胺基的氧杂环丁烷经酸活化后会发生分子内氧杂环丁烷开环并自发环化形成噁唑啉环(Scheme 1b),这样产生的噁唑啉在4-位带有羟基可供修饰,该取代基的存在与上述重要的分子和配体完全匹配(如Figure 1和Scheme 2),从而对其可以进行快速合成。 而且,这种方法原则上是可以催化的,对传统方法是一种补充。
(图片来源:Chem. Sci.)
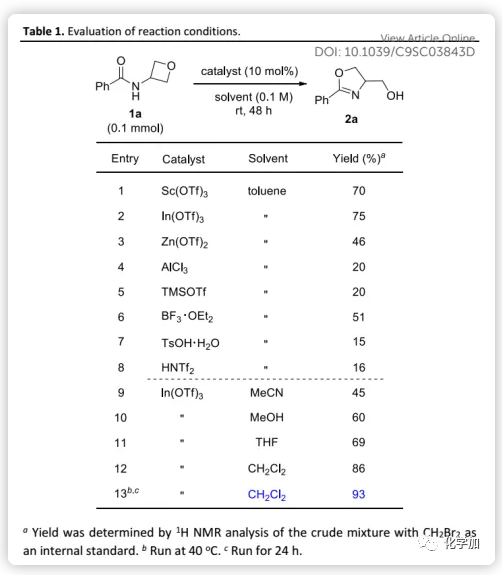
首先,作者以1a作为模型底物,考察了用于活化氧杂环丁烷片段的各种Lewis酸(Table 1)。虽然大多数均具有催化活性,但Sc(OTf)3和In(OTf)3的催化效率更高且后者略好。因此,在10 mol% In(OTf)3存在下,1a在室温甲苯中顺利反应以75%的收率得到噁唑啉2a。然而,Brønsted酸如TsOH和HNTf2表现出极低的催化转化率。接下来,作者对溶剂的考察发现:极性和质子溶剂如MeCN和MeOH导致低反应性,而DCM可以提高反应效率(86%产率)。最后,在40 ℃条件下,反应时间缩短至24 h,产率提高至93%。
(图片来源:Chem. Sci.)
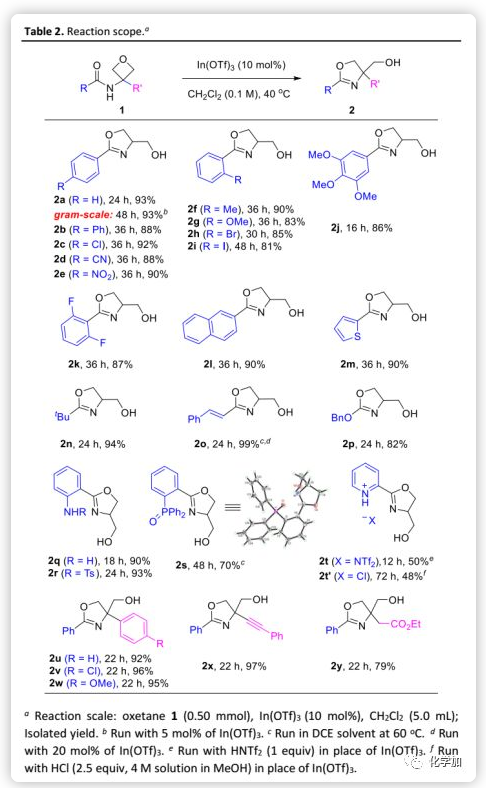
在最佳反应条件下,作者考察了该方法的普适性(Table 2)。含有不同电性的3-酰胺基氧杂环丁烷均可在温和条件下发生分子内环化得到相应的2-噁唑啉;芳香族和脂肪族酰胺均是合适的底物。此外,α,β-不饱和酰胺和氨基甲酸酯也可以参与反应得到2-位分别含有乙烯基和烷氧基的噁唑啉。该环化基本不受酰胺官能团的空间位阻的影响,从而可以在产物中引入杂环。鉴于噁唑啉作为配体的多功能性,作者还评估了合成双齿配体的可能性。例如,游离和受保护的氨基与氧化亚磷酸空间很近,虽然后者需要稍高的温度,但仍能高效地形成相应的噁唑啉产物;其中,2s的结构通过单晶X-射线衍射确证。值得注意的是,In(OTf)3未能催化含吡啶的底物1t的反应,可能是由于吡啶片段与In(OTf)3竞争结合导致催化剂失活。
然而,经过(过量)化学当量的酸如HNTf2和HCl进一步优化后,可以得到预期的噁唑啉盐产物。3,3-二取代的氧杂环丁烷也可以参与反应得到4,4-二取代的噁唑啉。总之,这种温和的条件可以耐受各种官能团如醚、硝基、腈、芳基卤、胺、酯、烯烃和炔基。此外,该方法在克级规模也表现出了高效的反应性。值得注意的是,与抗菌天然产物spoxazomicin C(Figure 1)相比,这些噁唑啉产物还应具有抗菌活性,并可以直接用于“构效关系”研究,进一步突出了的该反应合成效率。
(图片来源:Chem. Sci.)
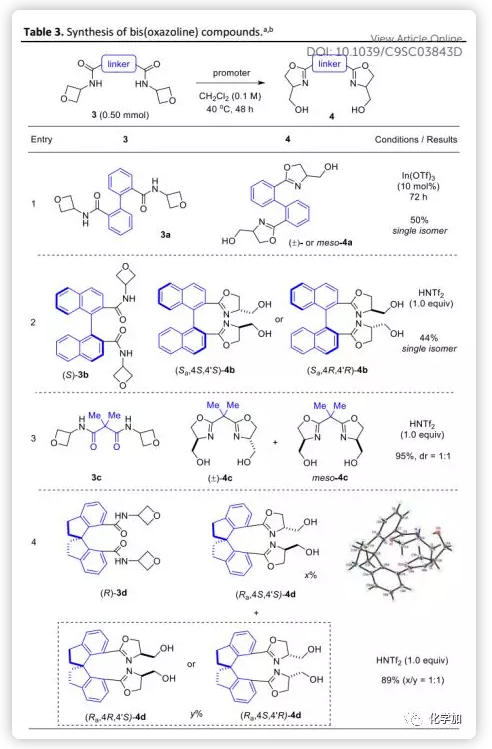
接下来,作者评估了该方法在合成双(噁唑啉)化合物方面的能力(Table 3)。双(酰胺)底物3经双重环化可以得到含不同“Linker”的双(噁唑啉)产物4。其中,4b和4d是以其对映体形式获得,而4a和4b是作为单一异构体得到。虽然尚未有明确的解释,但这很可能是由于最初形成的噁唑啉片段的空间取向影响了后续的环化。产物4b-d是已知的优良二齿配体,证明In(OTf)3不如HNTf2有效。值得注意的是,根据“Linker”的光学纯度,这些产物可以对映体的形式生成并直接用作手性配体。
(图片来源:Chem. Sci.)
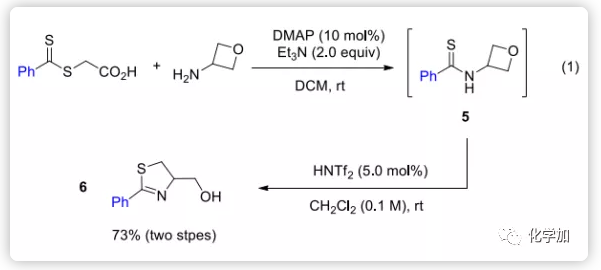
通过将酰胺单元替换为硫代酰胺,作者进一步扩展了该方法用以合成在天然产物、药物化学和有机合成中常见的杂环:2-噻唑啉环。虽然硫代酰胺5不稳定,但其可以通过2-((苯基硫代甲酰基)硫代)乙酸和3-氨基氧杂环丁烷原位生成,再经HNTf2处理后无需纯化即可得到所需的2-噻唑啉6,两步总收率为73%(Eq 1)。
(图片来源:Chem. Sci.)
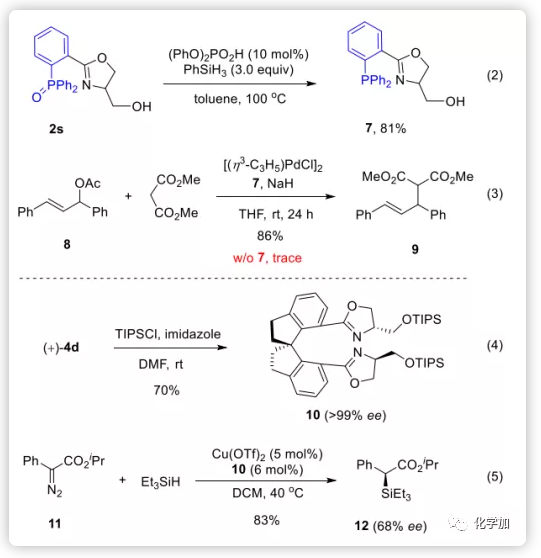
为了证明该反应的实用性,作者将噁唑啉产物用于合成反应的配体。例如,氧化膦2s经简单还原可以得到P,N-配体7(Eq 2),利用该配体可以实现钯催化下8的烯丙基取代以86%的收率得到产物9(Eq 3);然而,不加配体时,仅生成痕量产物。在另一个实例中,对映体纯的螺环双(噁唑啉)产物4d经TIPS保护得到的手性配体10可用于将卡宾不对称插入到三乙基硅烷的Si-H键中(Eq 4-5),并且不经条件优化的情况下,可以83%的收率得到α-甲硅烷基酯12(ee,68%)。进一步优化其他反应参数,可能会改善结果。
(图片来源:Chem. Sci.)
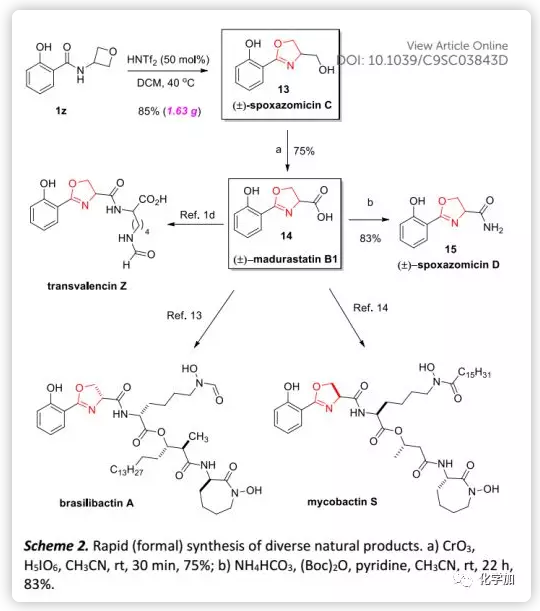
最后,作者通过快速合成各种天然产物进一步证明了该方法的实用性(Scheme 2)。例如,天然产物(±)-spoxazomicin C(13)可以由酰胺1z进行环化直接获得,再经简单的氧化得到另一种天然产物(±)-madurastatin B1(14),然后在NH4HCO3存在下再进一步转化得到另一种天然产物(±)-spoxazomicin D。此外,酸14是其他天然产物如transvalencin Z、brasilibactin A和mycobactin S的已知前体以及oxachelin C的潜在中间体,而上述天然产物均表现出有趣的抗菌活性。因此,作者开发的方法不仅为其集群式合成提供了独特有效的途径,而且还可以进行结构修饰用于药物研究。
(图片来源:Chem. Sci.)
小结:香港科技大学孙建伟团队开发了一种新的温和的催化方法,可以实现由基于β-羟基或不饱和酰胺的氧杂环丁烷通过非催化环化合成噁唑啉,这不仅是对噁唑啉合成策略的有力补充,也是对氧杂环丁烷反应性的扩展,特别是对于杂环的合成。作者筛选的Lewis酸催化剂In(OTf)3可以使各种易得的3-酰胺基氧杂环丁烷在温和条件下进行环化得到相应的噁唑啉。该方法也适用于各种二齿配体以及具有广泛应用性的双(噁唑啉)化合物的合成。此外,通过该方法所得到的产物,通常含有4-羟甲基取代基侧链,这与许多天然产物和抗菌分子的结构完全一致。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn