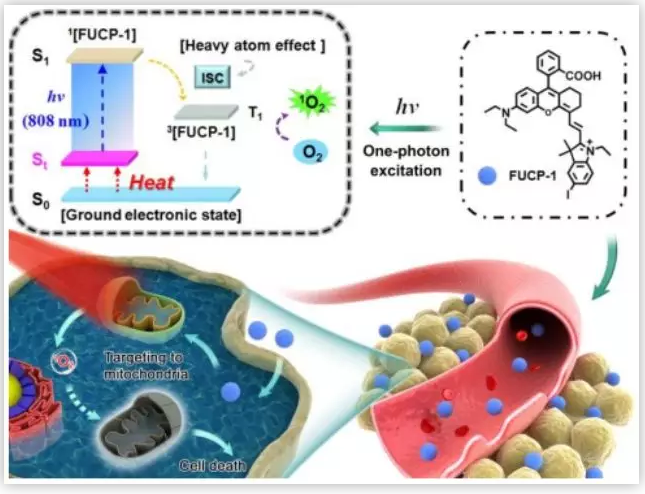
图1. FUCP-1 用于PDT示意图(图片来源:Chem. Sci.)
光动力治疗是临床认可的一种非侵入性癌症治疗方式,该治疗方式依赖于光动力治疗媒介,即光敏剂(PSs)。光敏剂在没有受到光照射时对正常细胞是基本无毒的,但是用特定的光照射后,在肿瘤部位产生单线态氧或自由基,就变得对肿瘤细胞是高毒性的,从而杀死肿瘤细胞。传统的光敏剂是对可见光(波长在400–700 nm)响应的,但是可见光组织穿透力差,无法穿透深层组织,启动深层组织的光动力治疗。相反,近红外(NIR)的治疗窗口(700-900nm)可以有效的穿透深层组织且只会造成轻微光损伤,因此用近红外光实现深层组织的光动力治疗对进一步临床应用十分重要 。现有的NIR光敏剂存在合成困难,抗光漂白性差,产生有效活性氧(ROS)的效率低,对深层肿瘤杀伤效果不佳等缺点。为了克服这些缺点,上转换发光成了深层肿瘤光动力治疗的焦点。上转换发光就是吸收低能量长波长的光子发射高能量短波长的光,即反斯托克斯发光。上转换发光,又分为稀土上转换发光、双光子吸收(TPA)、频率上转换发光。相较与其它两种发光材料,频率上转换发光材料具有更低的毒性(稀土毒性大)且更易引发深层肿瘤的光动力治疗(双光子需要更多的能量激发)。但是目前少有研究FUCL用于抗肿瘤。因此,彭孝军院士课题组设计合成了一种单光子激发的频率上转换光敏剂FUCP-1用于深层肿瘤光动力治疗。
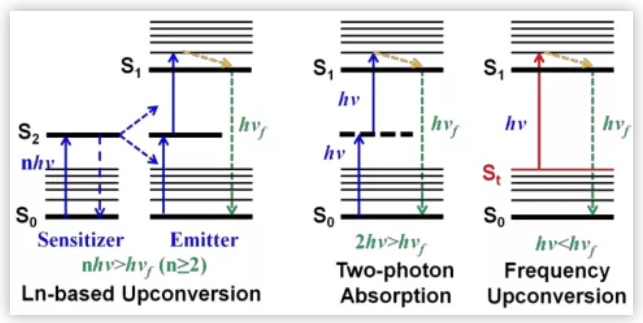
图2. 不同上转换机理示意图(图片来源:Chem. Sci.)
作者选择罗丹明衍生物作为FUCP-1的骨架。这是因为罗丹明结构具有优良的热带(hot-band)吸收能力能够产生反斯托克斯发射(长波激发,短波发射)。在单光子上转换的光动力治疗过程中,引入碘原子(I)极大的促进了激发单线态S1向激发三重态T1的转变(系间穿越,ISC)。ISC能力的增加极大的促进了单线态氧的产生。不同于传统的斯托克斯发射(短波激发,长波发射),FUCP-1的上转换过程可以通过长波(808 nm)激发。值得注意的是,FUCP-1具有良好的上转换发光量子产率(>12%)和优秀的光稳定性。此外FUCP-1可以有效的产生单线态氧,并且对4T1细胞有很高的抑制作用。FUCP-1通过静脉注射到体内后,在肿瘤部位聚集。用808 nm的光照射后,对肿瘤的抑制效果极佳(~73.7%)。更重要的是24h内FUCP-1就会从体内被清除,因此在PDT过程中对正常组织毒性极低。这些优点表明,单光子频率上转换光敏剂FUCP-1,可作为一种理想的光治疗平台用于深部肿瘤治疗。
作者在合成了FUCP-1之后,对FUCP-1的上转换发光性质进行了研究。结果表明,FUCP-1适合用于长期的影像观察和光子引发的癌症治疗。基于FUCP-1的光物理性质,作者对FUCP-1产生单线态氧的能力进行了分析。作者利用商业染料DPBF对比了FUCP-1与其非卤代类似物NRh-1产生单线态氧的能力,确定了碘原子的重原子效应有利于触发单光子上转换过程,产生单线态氧。随后,作者还研究了温度对上转换过程的影响,结果表明提高温度,有利于上转换过程的发生。在体外结果的基础上,作者对FUCP-1在细胞内产生单线态氧的水平进行了分析。利用SOSG(一种检测单线态氧的试剂)确定了FUCP-1上转换过程中产生的ROS就是单线态氧。
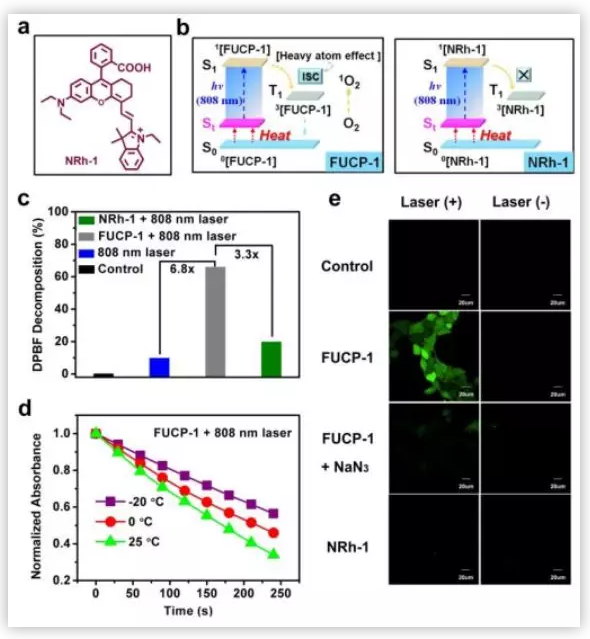
图3. FUCP-1产生单线态氧能力的分析(图片来源:Chem. Sci.)
随后,作者研究细胞对FUCP-1的摄取和FUCP-1在细胞中的定位,并且评价了体外单光子上转换激发诱导的细胞毒性。研究结果表明,FUCP-1可以很快被肿瘤细胞摄取,并聚集在线粒体中。毒性研究也表明FUCP-1有很好的生物相容性。这些结果都显示FUCP-1有很好的PDT能力。
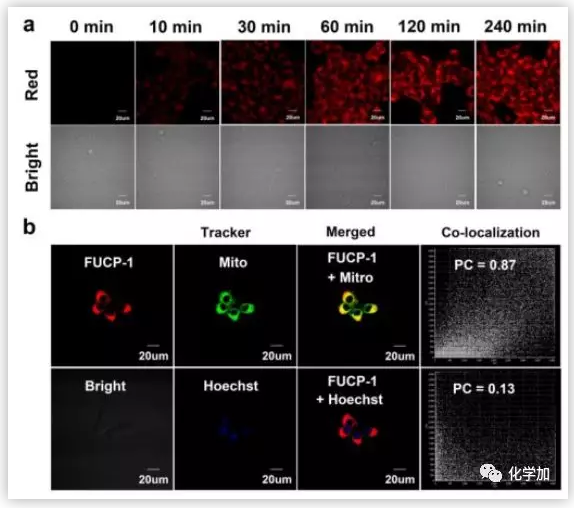
图4. FUCP-1被肿瘤摄取及在肿瘤中的位置(图片来源:Chem. Sci.)
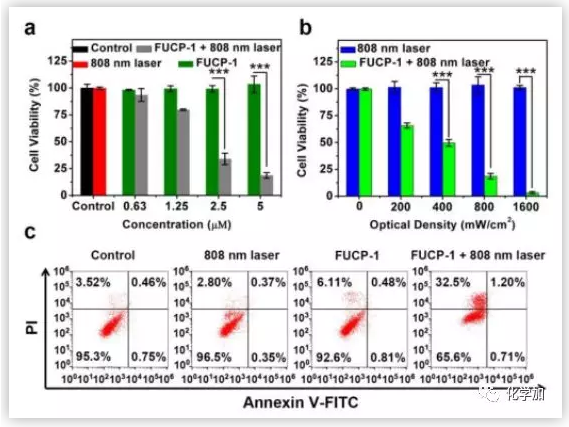
图5. 毒性评价(图片来源:Chem. Sci.)
基于体外的研究结果,作者进一步研究FUCP-1在体内对深层肿瘤的PDT效果。通过静脉注射将FUCP-1注射到移植有4T1肿瘤的小鼠体内,结果表明FUCP-1在肿瘤部位聚集。然后作者评价了PDT效果,用808 nm照射注射了FUCP-1的肿瘤部位,肿瘤细胞生长受到抑制。
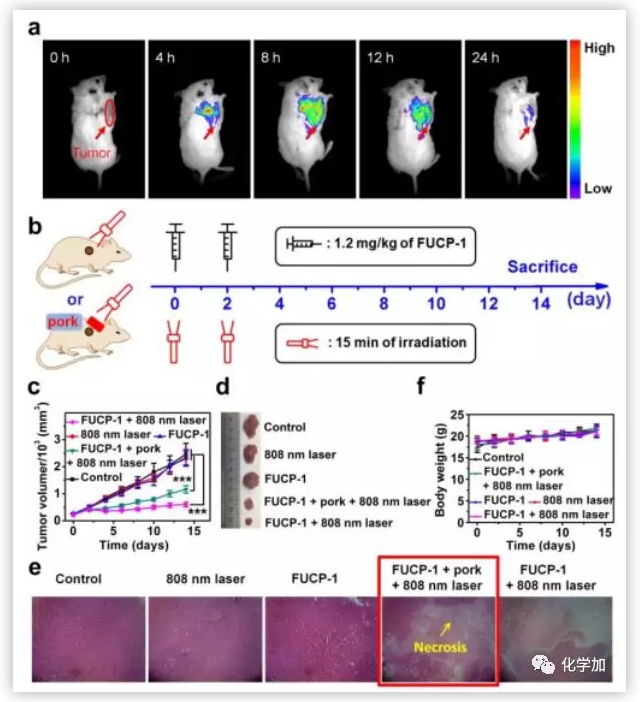
图6. 肿瘤部位成像及体内PDT效果(图片来源:Chem. Sci.)
总结:大连理工大学彭孝军院士课题组基于频率上转换发光原理设计了一种单光子上转换光敏剂FUCP-1用于深层肿瘤光动力治疗,这是首次报道频率上转换发光用于光动力治疗。FUCP-1量子产率高,光稳定性好,有利于实时监控其在体内对肿瘤的靶向性;而且24小时内从体内排除,系统毒性小。因此,FUCP-1有望作为一种基于光子驱动的深部肿瘤治疗手段,为多功能光敏剂的设计提供一种理想的分子上转换平台。
撰稿人:犟子柳







