

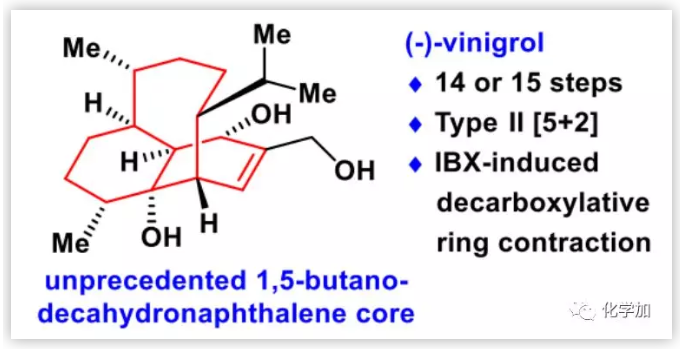
(-)-vinigrol(1,Fig. 1)是由Hashimoto课题组于1987年从真菌菌株Virgaria nigra F-5408中分离得到的一种独特的二萜。在结构上,(-)-vinigrol具有前所未有的高度刚性的十氢萘母核,并且含有八个连续的手性中心;其中,1的高张力双环[5.3.1]十一烷作为独特的桥环骨架,也存在于萜烯紫杉醇中。此外,(-)-vinigrol显示出多种生物活性,不仅可以抑制人血小板凝集(IC50=52 nM),还是肿瘤坏死因子(TNF-α)的拮抗剂。
(-)-vinigrol独特的结构特征和药理活性,引起了合成界的极大兴趣。2009年,Baran课题组以Diels-Alder反应和Grob碎裂化为关键步骤完成了(-)-vinigrol的首次全合成。2012年,Barriault课题组通过II型分子内Diels-Alder反应完成了(-)-vinigrol的全合成。2013年,Njardarson课题组以氧化脱芳构化和分子内Diels-Alder反应为关键步骤完成了(-)-vinigrol的全合成。最近,罗佗平课题组以跨环Diels-Alder反应为关键步骤完成了(-)-vinigrol的首次不对称全合成。可以看出,Diels-Alder反应是(-)-vinigrol合成策略的关键因素。近日,南方科技大学李闯创课题组利用II型分子内[5+2]环加成反应作为关键步骤完成了(-)-vinigrol的不对称全合成,该成果发表于近期J. Am. Chem. Soc.(DOI:10.1021/jacs.9b08983)。
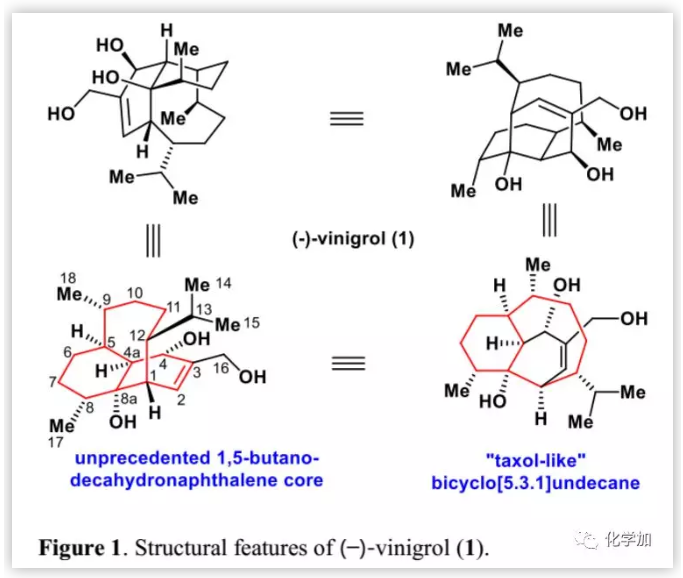
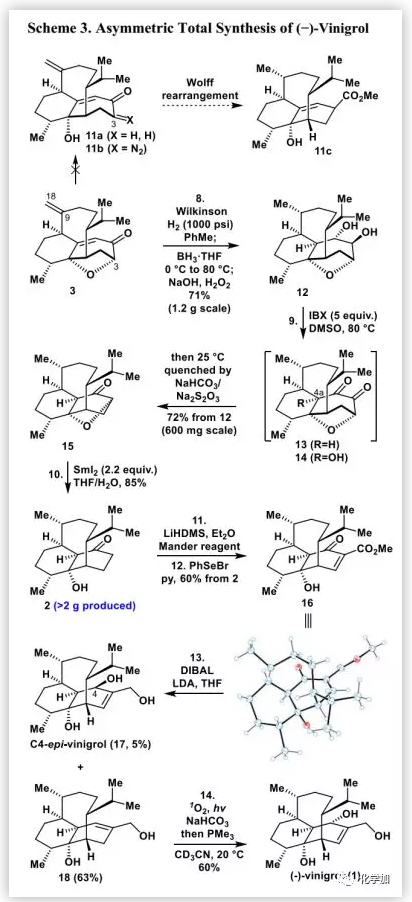
(-)-vinigrol的逆合成分析(Scheme 1):(-)-1可以由三环母核2通过一系列官能团转化得到,而化合物2可以由3或其衍生物通过缩环反应合成。反过来,在C4-C4a位含有张力桥头双键的桥环3可以由4通过II型分子内[5+2]环加成不对称合成。化合物4则可以由5通过Achmatowicz反应合成。最后,化合物5可以由易得的溴化物6和氯代-二氢香芹酮(7)通过简单的官能团转化来制备。
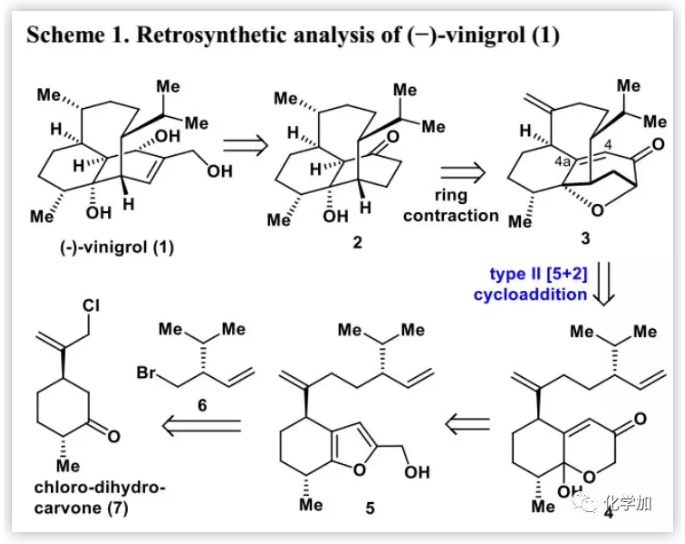
化合物5的不对称制备(Scheme 2):作者用LiHMDS和2-氯乙酰氯(8)处理起始原料7,然后经DIBAL-H还原得到得到呋喃9(40%)。3-甲基丁醛经不对称α-羟甲基化,然后进行Wittig烯化和溴代得到溴化物6。在CuI催化下,用溴化物6制备的格氏试剂和呋喃9反应得到化合物10(94%)。然后,在正丁基锂作用下在10的呋喃环α-位进行羟甲基化得到5(82%)。在DCM中,VO(acac)2/TBHP条件下5进行氧化重排得到4(92%),即II型分子内[5+2]环加成反应的前体。
2014年,作者开发了II型分子内[5+2]环加成反应,其涉及oxidopyrylium叶立德和简单的烯烃(如4b),可以高效、非对映选择性地直接构建各种高度官能团化和具有挑战性的桥环骨架(如3)。然而,在双环[5.4.1]十二烷或双环[5.3.1]十一烷存在额外的C9=C18双键增加了分子的张力。迄今为止,尚无关于(a)脂族环稠合的oxidopyrylium叶立德如4b的分子内[5+2]环加成反应或(b)在天然产物合成中构建八元环的文献报道。此外,在3的桥环结构中,构建C8a位手性季碳桥头中心充满挑战性。
经过广泛的研究(Scheme 2),作者发现在C8a位含三氟乙氧基的化合物4a是进行II型分子内[5+2]环加成的oxidopyrylium叶立德4b的良好稳定前体,其由4经Boc2O保护,然后在AgSbF6存在下,用2,2,2-三氟乙醇(TFE)进行三氟乙氧基化制备得到(85%)。在优化的反应条件即氢化奎尼丁(0.2 eq.)催化并加热下,实现了4a的II型分子内[5+2]环加成得到[6-8-7]三环母核3(10 g,40%),其结构通过单晶X-射线衍射确证。这是在[5+2]环加成中用三氟乙氧基离去基团产生oxidopyrylium叶立德的首例报道。此外,作者开发的II型分子内[5+2]环加成反应不仅可以在3中有效构建类似紫杉醇的双环[5.3.1]十一烷骨架,还可以非对映选择性地直接引入之前难以实现的C8a位氧和C8位甲基。
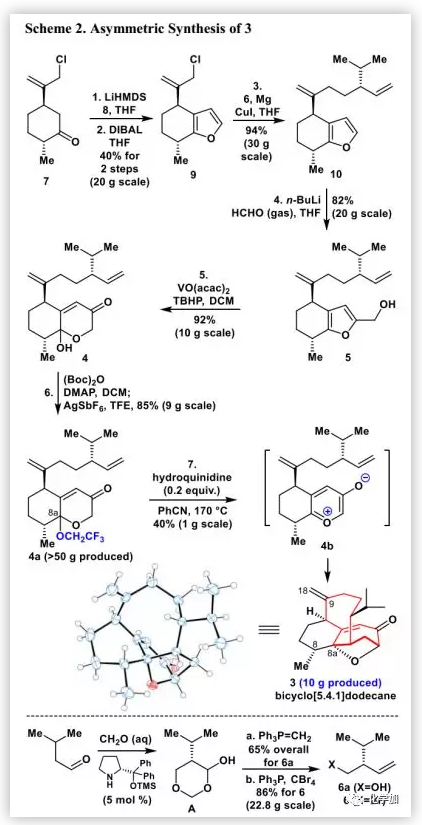
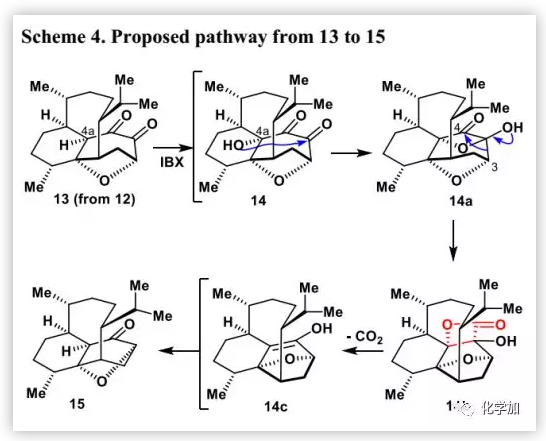
在得到化合物3后,作者尝试了通过缩环反应合成vinigrol的1,5-丁二醇十氢萘骨架(Scheme 3)。最初,作者尝试进行Wolff重排得到11c。可以预期的是,通过C3-O键的选择性裂解并在C3位引入重氮基团可以得到Wolff重排前体11b。作者筛选了各种条件(如SmI2、Li/NH3、Na/NH3和Li/EtNH2),均未能实现C3-O键的选择性裂解。大量实验表明,二酮13是制备α-酮重氮化合物的良好前体。因此,作者在甲苯中用Wilkinson催化剂/H2对C9=C18双键进行化学选择氢化,然后用BH3•THF对烯酮进行“一锅”法不对称硼氢化氧化得到二醇12(71%,1.2 g)。随后,在80°C的DMSO中,用IBX 2-碘氧基苯甲酸(2.0 eq.)处理12得到非预期产物14(30%)、单酮产物S4(30%)、缩环产物15(10%)和一些未鉴定的副产物。但是,未分离得到预期产物13。作者认为1,5-丁二醇十氢萘母核15可能通过以下途径形成(Scheme 4)。在IBX存在及80 ℃条件下,由12生成的二酮13自发氧化得到C4a-羟基二酮14,其C4a-羟基通过分子内进攻位阻较小的羰基得到氧杂环丁酮14a,再经重排得到不稳定的β-内酯14b,其结构通过2D-NMR、MS和IR确定。随后,β-内酯自发脱羧生成烯醇14c,将其进行酮-烯醇互变异构非对映选择性地得到产物15。通过反应条件的进一步优化,作者确定了最佳反应条件:在80 ℃的DMSO中,用IBX(5.0 eq.)处理12,2 h后用NaHCO3/Na2S2O3淬灭反应,可以72%的分离产率得到15(600 mg)。在相似条件下,将分离得到的14或14b进一步反应分别以高收率得到15。
值得注意的是,环状1-羟基-2,3-二酮是合成α-酮重氮化合物用于Wolff重排的前体,但关于其直接缩环的研究鲜有报道。在某些情况下,这种温和的反应可能是进行缩环的替代方法。
接下来,作者用SmI2(2.2 eq.)处理15得到酮2(85%),其经LiHDMS和Mander试剂处理后,与PhSeBr进行苯基硒化再自发消除得到烯酮酯16(60%),其结构通过单晶X-射线衍射确证。然后,作者尝试通过一步完成16中酮羰基和酯基的选择性不对称还原得到(-)-1。但是,大量的实验尝试均告失败。然而,在LDA存在下,用DIBAL-H处理16得到C4-epi-vinigrol(17,5%)和化合物18(63%)。最后,作者对先前的合成步骤稍加修改,通过18的单线态氧烯反应完成了(-)-1(60%)的不对称全合成。
撰稿人:爽爽的朝阳
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn