

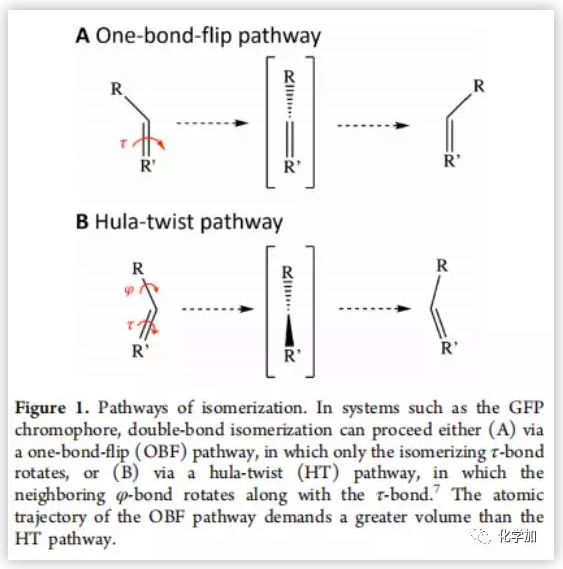
光异构化反应由于其灵敏的感光生物学功能,被广泛的应用于化工领域,如光学数据储存、分子转换。光异构反应中,以双键顺反异构化最为常见。共轭体系如绿色荧光蛋白(GFP)双键的异构化有两种途径,单键翻转(OBF)和键角扭转(HT)(Figure 1)。OBF途径只有τ键旋转,而HT途径相邻的φ键随着τ键旋转,OBF途径的原子轨道所需要的体积比HT途径大。因此,OBF途径常发生在允许自由运动的环境中,而HT途径常发生在空间受限的环境中。
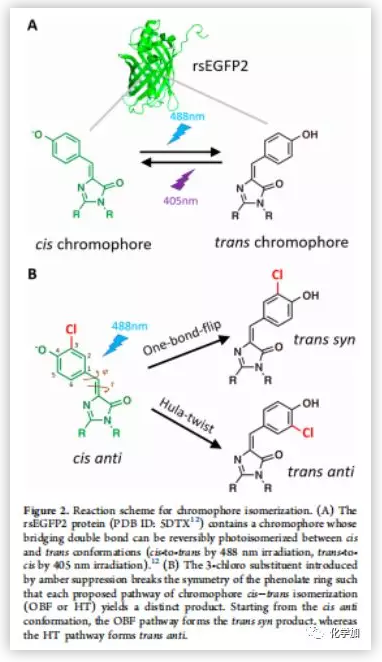
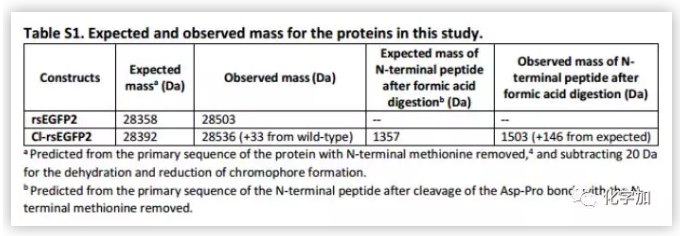
为了探寻绿色荧光蛋白(GFP)双键光学异构化的途径,作者以rsEGFP2(可逆转换增强绿色荧光蛋白2) 为模型进行检测。rsEGFP2具有易结晶的特点和良好的光学特性。β-桶状折叠的rsEGFP2发光团自然条件下呈现顺式构象,在488nm的激光照射下很容易异构化为反式构象,相反,在405nm的激光照射下,反式构象异构化回顺式构象。rsEGFP2还有一个显著的优点,rsEGFP2很容易被基团取代用来区分OBF和HT途径。在野生型细胞中,rsEGFP2通过两种途径产生相同的反式产物。但如果取代基破坏rsEGFP2酚环的对称性,两种途径就会产生不同的产物。当带有取代基的cis rsEGFP2发生OBF途径时,变为trans syn,发生HT途径时,变为trans anti(Figure 2B)。通过琥珀抑制使3-氯酪氨酸替换67残基处的酪氨酸,生成一个邻位氯取代的酚氧色团。此变体Cl-rsEGFP2与野生型rsEGFP2有类似的光敏特性(Table S1)。
(图片来源:J. Am. Chem. Soc.)
(图片来源:J. Am. Chem. Soc.)
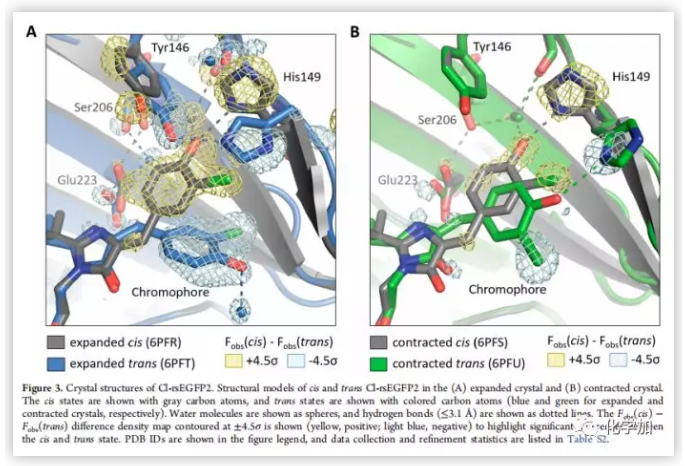
以发光团cis状态为准,氯取代基处于anti的方向(Figure 3A)。当发光团异构化为trans,氯取代基处于syn的方向,并且Cl-rsEGFP2的两个环不再平行(τ = 12°, φ = −13° in cis; τ = 187°, φ = −32° in trans τ 为N−C=C−C1二面角,φ 为 C=C−C1−C6二面角)(Figure 2B),另外,空间构象轻微扭曲形成新的反式构象,酚羟基不再与His149形成氢键,而与水分子形成氢键。His149与Tyr146形成氢键(Figure 3A)。
作者统计比较了一些Cl-rsEGFP2的晶体数据,发现一些晶体的单位尺寸大小比之前报道的小7%,众所周知,当水进入或离开单个蛋白质之间的溶剂通道时,蛋白质晶体会膨胀或收缩。实验操作的微小变化会导致Cl-rsEGFP2的溶剂含量变化。作者发现可通过将Cl-rsEGFP2晶体浸泡在相对湿度较低的低温保护剂中,来控制降低Cl-rsEGFP2的晶格间距。低温保护剂可将水从晶体中抽出,使之更紧密聚集在一起,从而得到“收缩”晶体。当Cl-rsEGFP2收缩成更紧密的晶格时,其折叠方式不变,但尾部和环路区域出现了轻微偏差。蛋白质在cis状态下收缩晶体与膨胀晶体的内部几何构型相同,trans状态下收缩晶体与膨胀晶体相比空间结构明显扭曲。有趣的是,trans状态下收缩晶体Cl-rsEGFP2的两个环平行,且与与His149形成氢键(Figure 3B)。这种现象在多个晶体中都有发现。Cl-rsEGFP2的晶体结构表明,晶格的微小重排可以改变光异构化途径。由于顺反异构化反应对介质的空间结构很敏感,膨胀晶体常以OBF途径异构,而收缩晶体则以HT途径异构。
(图片来源:J. Am. Chem. Soc.)
Kao等人以Dronpa(可逆光致变色荧光蛋白)为研究对象,观察到介质粘度增加会减慢Dronpa的光敏速率,无论是溶剂粘度还是晶体填料都会影响发光团异构化,表明发光团的异构化与蛋白质的β-桶状折叠运动是耦合的。本文作者研究结论与其相似。Cl-rsEGFP2的结晶条件可能会干扰蛋白质的结构并引起功能后果。众所周知,蛋白质的向外残基和柔性环在晶体内可能相互作用引起结构改变,而蛋白质内部很少受到影响。而本文中,trans Cl-rsEGFP2的晶体结构单位体积收缩7%时,出现了明显的结构改变,说明晶体填充的相互作用影响了trans Cl-rsEGFP2内残基的构象。
小结:本文详述了Cl-rsEGFP2晶体顺反异构化的机理。显然,蛋白质异构化的途径不是蛋白质所固有的,而是取决于蛋白质在晶体中的构象。膨胀晶体常以OBF途径异构化;单位体积收缩7%的收缩晶体常以HT途径异构化。研究发现发光团的异构化与蛋白质的β-桶状折叠运动是耦合的。在不同的荧光蛋白中,异构化的机制可能不一样。研究结果表明结晶条件可能会导致蛋白质面向内的残基结构重排。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn