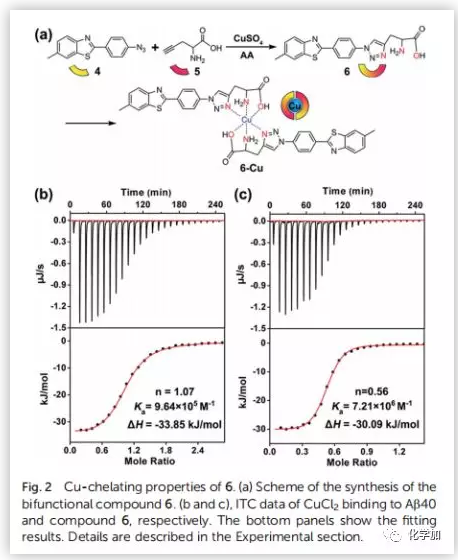
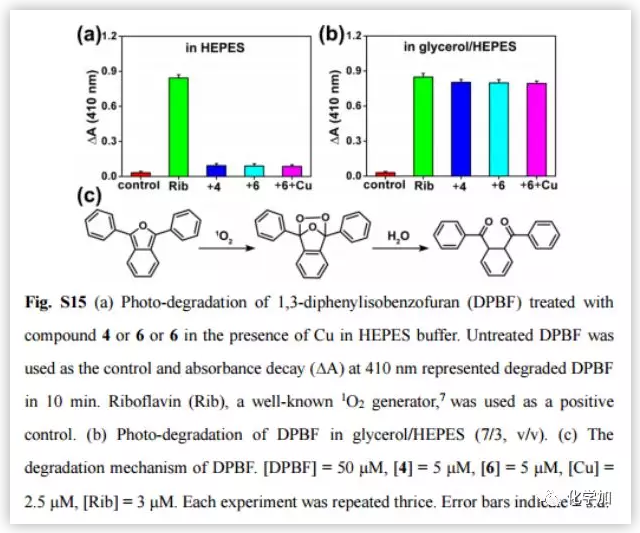
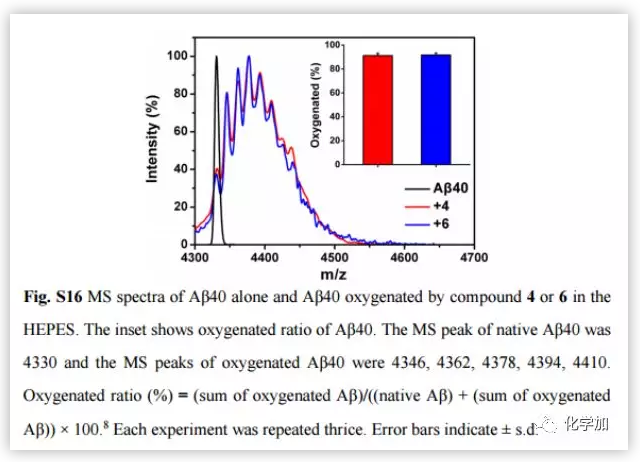
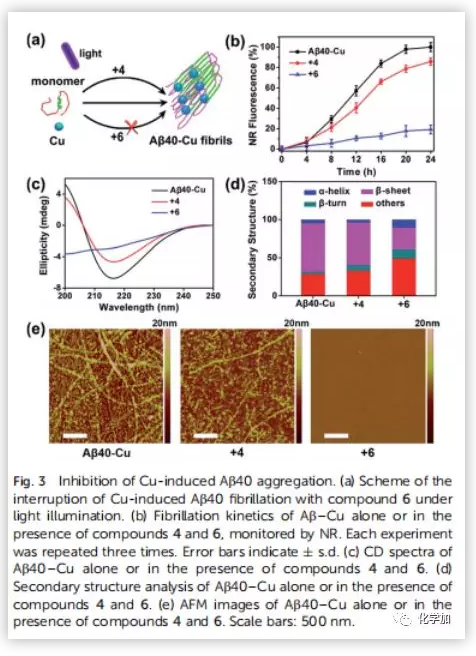
阿尔茨海默病(AD)影响着全球约5000万人,大量研究证明AD与β-淀粉蛋白(Aβ)聚集和铜离子浓度失调密切相关。正常大脑中的铜含量为0.2-1.7 uM,而Aβ斑块中铜的浓度可达0.4 mM。铜是生命不可或缺的元素之一,铜浓度的波动与多种疾病有关,包括门克斯病、威尔逊病等遗传病;阿尔茨海默病、帕金森病、亨廷顿病、朊病毒病等神经退行性疾病。对于与铜积累引起的疾病,最常见的治疗策略是直接使用铜螯合剂。然而,由于螯合剂的无特异性可能会引起很多副作用。近日,曲晓刚研究员课题组设计用Aβ特异性光敏剂4与Cu预螯合剂5合成双功能化合物6(Fig.2a),是一种很有吸引力的AD治疗药物。光氧化Aβ可以通过增强蛋白极性分解Aβ聚集物,而铜离子可以协调促进Aβ聚合。因此,由铜积累的β-淀粉蛋白(Aβ)斑块(Aβ-Cu聚集体)催化叠氮-炔烃生物正交环加成反应(CuAAC),原位合成具有光氧化Aβ和螯合Cu特性的药物就能有效地体内分解Aβ-Cu聚集体。作者采用光谱滴定法和等温滴定量热法(ITC)测定了化合物6与铜的结合度(n)和结合亲和力。在ITC测定中,铜与Aβ40和化合物6表观结合常数(K)分别为9.64 x 105 M-1和7.21 x 106 M-1(Fig.2b and 2c)。化合物6与铜的亲和度适宜于破坏Aβ40-Cu相互作用,而不影响酶的正常功能。作者评估了化合物6对Aβ的光氧化能力。采用1,3-二苯异苯并呋喃(DPBF)检测光激发化合物6生成的单线态氧(1O2)。利用甘油增加溶液粘度,限制化合物6的键旋转。与(HEPES)缓冲液作对照,化合物6在甘油/HEPES混合溶液中产生更多的1O2(Fig.S15)。Aβ40的MS峰为4330,光氧化Aβ40的MS峰为4346、4362、4378、4394、4410,证实了化合物6可以有效地光氧化Aβ40(Fig.S16)。探究化合物6对Cu加速Aβ40聚集反应的抑制作用。用尼罗红(NR)检测Aβ40单体(10 μM)和Cu (10 μM)单独存在,和与化合物4和6共同存在时的纤维震颤。圆二色性(CD)、AFM检测Aβ40的聚集情况。随着潜伏期的延长,Cu诱导Aβ40形成大量β层状折叠的纤维,化合物6阻断了这一过程。然而,由于缺乏螯合Cu的部分,化合物4不能抑制Cu诱导的Aβ40聚集(Fig.3)。
(图片来源:Chem. Sci.)
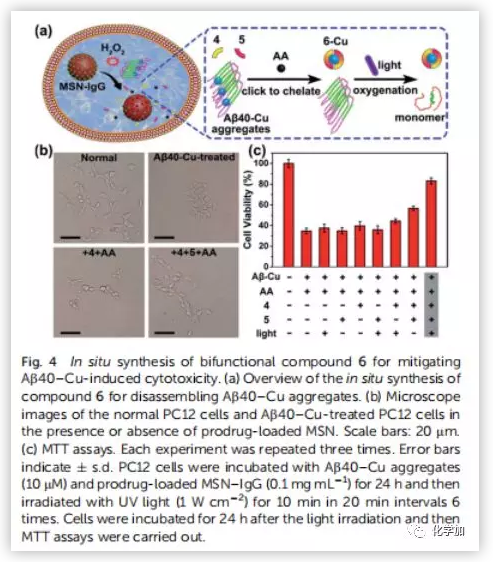
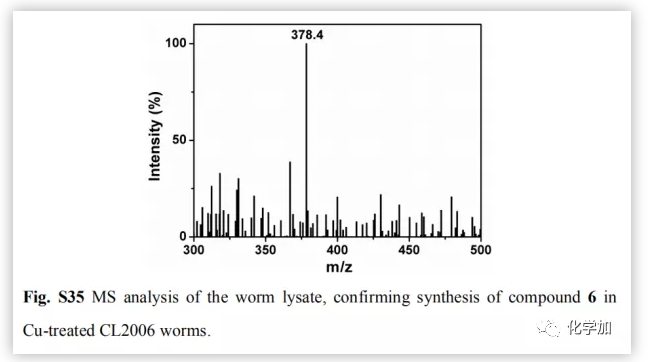
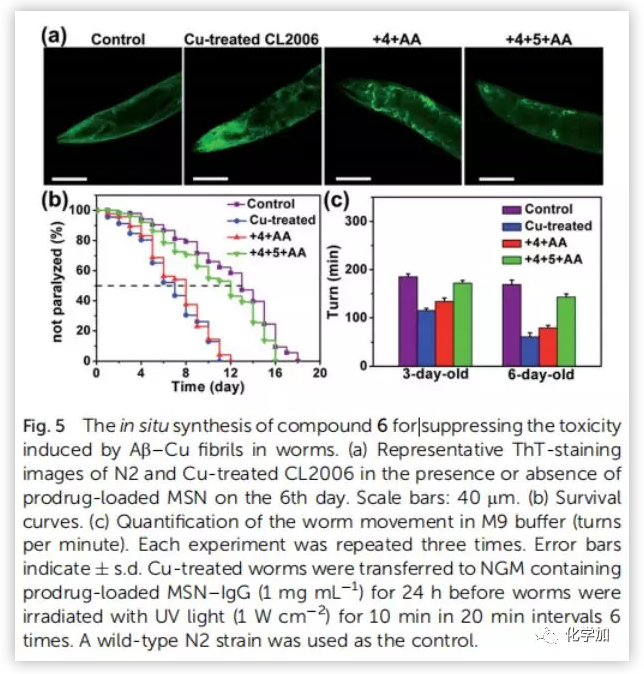
为了评价原位合成药物6在细胞中的治疗潜力,将PC12细胞与Aβ40-Cu聚集物和前药负载的MSN-IgG9(对Aβ40-Cu催化产生的H2O2敏感)共同孵育。前药(4,5和AA)在细胞中释放(Fig.4a)。然后Aβ40-Cu聚合物催化CuAAC反应,原位合成化合物6。此外,化合物6的产量随着Aβ-Cu浓度的增加而增加。因此,在不使用外源性铜催化剂的情况下,原位药物合成可以通过细胞中Aβ40-Cu聚集物的水平自我触发和调节。Aβ40-Cu聚合物破坏了细胞形态,导致细胞死亡。相比之下,原位合成药物6使PC12细胞恢复正常形态,使细胞存活率从37%提高到82%。然而,化合物4没有表现出类似的保护作用(Fig.4b and 4c)。结果表明,化合物6 通过螯合铜和光氧化Aβ,抑制Aβ40-Cu聚集物所引起的细胞毒性。然后,作者探讨了化合物6的原位合成是否能抑制Aβ40-Cu聚集物引起AD模型秀丽线虫CL2006的麻痹。MS证实经过Cu处理的CL2006中合成了化合物6(Fig.S35)。生长曲线证明,Aβ40-Cu聚合体可诱导AD模型CL2006株麻痹,缩短其寿命,并导致行为缺陷,而原位合成的化合物6可减少Aβ40-Cu聚集物,抑制CL2006麻痹,提高其活动力(Fig.5b)。
总结:曲晓刚研究员课题组设计原位合成的双功能药物,具有光氧化Aβ和螯合Cu特性,能有效地体内分解Aβ-Cu聚集体。由铜积累的β-淀粉蛋白(Aβ)斑块催化叠氮-炔烃生物正交环加成反应(CuAAC),激活荧光团并进行药物合成,可以实现AD治疗的自触发和自调节。在活细胞、转基因AD模型秀丽线虫CL2006以及三转基因AD小鼠的大脑切片中都有效果。作者的研究为利用内源性神经毒性金属离子原位合成治疗神经退行性疾病的多功能药物开辟了新的途径。