

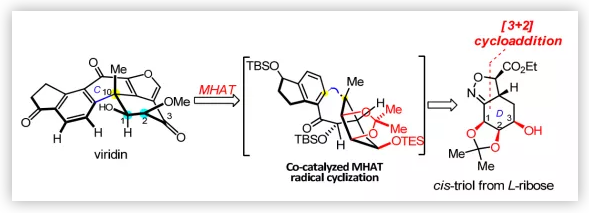
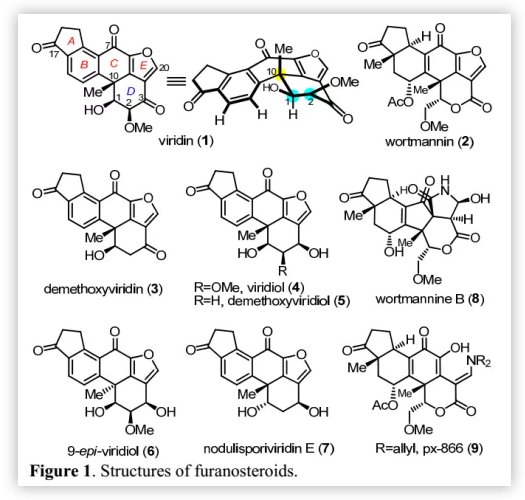
源于Gliocladium virens的呋喃甾体化合物viridiin(1)和源于Penicillium wortmannii的化合物wortmannin(2)与天然产物demethoxyviridin(3)、viridiol(4)、demethoxyviridiol(5),9-epi-viridiol(6)和nodulisporiviridin E (7)和dinor-carbon wortmannin衍生物如wortmannine B(8)(Figure 1)生源相关。呋喃甾体化合物具有很强的磷脂酰肌醇3-激酶(PI3K)抑制活性,而后者与肿瘤细胞的存活和生长密切相关。因此,这些化合物可以作为抗癌药进一步开发,但该类化合物如wortmannin(2)在体内降解迅速且有剧毒。Wipf等人对wortmannin进行结构修饰得到的PX-866(9)成药性增加,目前正在进行II期临床试验。近日,华东师范大学高栓虎教授课题组通过汇聚式方法完成了(-)-viridin(1)和(-)-viridiol(4)的不对称全合成。
(图片来源:J. Am. Chem. Soc.)
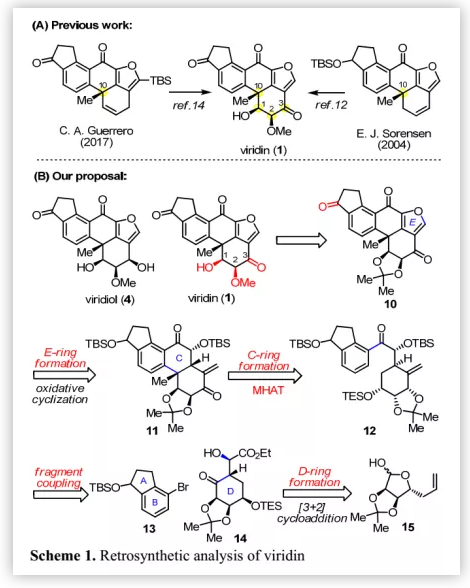
Viridin(1)含有高度氧化的甾体骨架(A-B-C-D环)和额外的呋喃环(E环)(Figure 1);其中,D环含有三个连续的手性中心,包括C-10位的苄位季碳手性中心和C-1,2位顺式二醇单元。基于结构分析,作者认为通过快速构建甾类骨架和立体控制氧化态可以提高其合成效率。2004年,Sorensen课题组通过铑催化的环三聚、闭环复分解和热电环化重排完成了viridin(1)和viridiol(4)的首次全合成;Guerrero课题组以不对称分子内Heck反应构建五环母核为关键步骤完成了1和4的不对称全合成。基于前人的工作,作者认为在D环中构建拥挤的顺式二醇片段最具挑战。迄今为止,所有的合成努力都集中在官能团引入和后期操作的立体化学控制上(Scheme 1A)。
Viridin的逆合成分析(Scheme 1B):作者尝试通过易得的手性源L-核糖引入手性顺式二醇片段,利用分子内[3+2]环加成反应构建含有关键的手性顺式三醇片段的D环中间体14,其与二氢茚三醇片段13偶联得到中间体12,其经钴催化的金属-氢化物氢迁移(MHAT)自由基反应实现C环闭环并构建出C-10位季碳手性中心。作者认为,MHAT环化的立体化学受底物控制,从而得到预期的四环化合物11。通过引入呋喃E环并改变D环的氧化态可以得到viridin(1)和viridiol(4);MHAT自由基反应不仅可以实现viridin(1)的大量制备,还是逆合成分析中进行断键的重要依据。
(图片来源:J. Am. Chem. Soc.)
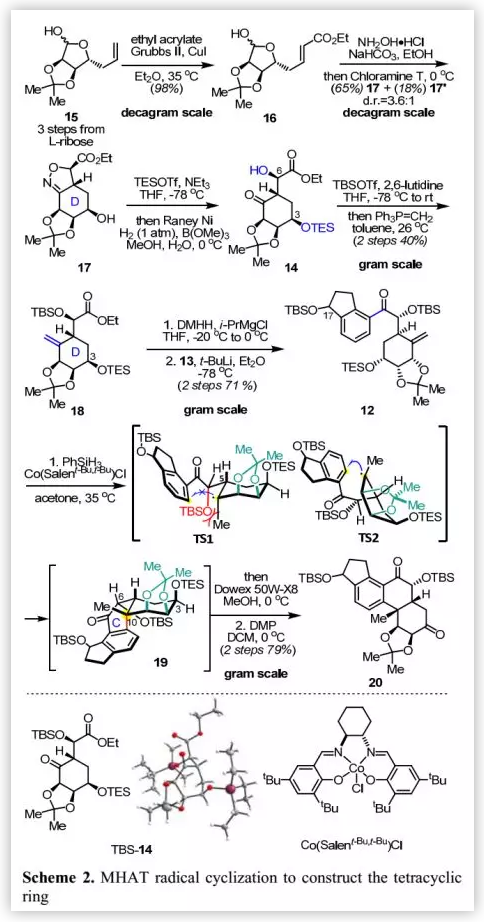
具体的合成路线(Scheme 2):作者以L-核糖为起始原料通过三步反应制备得到已知的糖衍生物15(>30 g),其经钌催化的烯烃交叉复分解反应转化为不饱和酯16(98%),再经羟胺处理得到的肟中间体直接用于后续[3+2]环加成反应。粗品肟经Chloramine T氧化生成腈氧化物后,被分子内不饱和酯捕获得到预期的异噁唑啉17(65%)及其非对映异构体17'(18%)(d.r.=3.6:1)。随后,将C-3位羟基进行TES保护后,通过“一锅”法进行异噁唑啉环的还原裂解得到含多个敏感官能团(如α-和β-羟基羰基片段)的化合物14,不经纯化,直接用于下一步转化。C-6位羟基经TBS保护得到的TBS-14的结构和立体化学通过单晶X-射线衍射确认,其经Wittig烯化得到末端烯烃18(40%,2步)。
将含D环所有必需官能团和立体中心的化合物18转化为其Weinreb酰胺后,与二氢茚酚片段(±)-13的阴离子反应得到12,作为C-17位非对映异构体混合物。受Shenvi和Baran等人工作的启发,作者尝试进行C环闭环并通过MHAT自由基反应在C-10位引入季碳手性中心。在PhSiH3存在和Co(Salent-Bu,t-Bu)Cl催化下,12以极好的收率转化为预期的四环母核19,作为单一非对映异构体。需要指出的是,这是MHAT反应首次用于合成芳香类甾体化合物。
作者认为,MHAT环化的立体化学受自由基中间体TS1和TS2的构型控制(Scheme 2),其中C-5位的侧链处于环己烷D环的平伏键。结构分析表明,TS1的D环转化为“椅式”构象可以避免由额外的缩酮环而引起的环张力,从而导致OTBS和甲基之间产生1,3-相互作用;TS2为扭曲的“船式”构象,但未产生上述空间效应。因此,TS2尽管具有更大的环张力,但仍是进行自由基环化得到四环母核19的优势过渡态。随后,选择性脱除TES保护基裸露C-3位羟基,经Dess-Martin氧化得到二羰基化合物20(79%,2步)。
(图片来源:J. Am. Chem. Soc.)
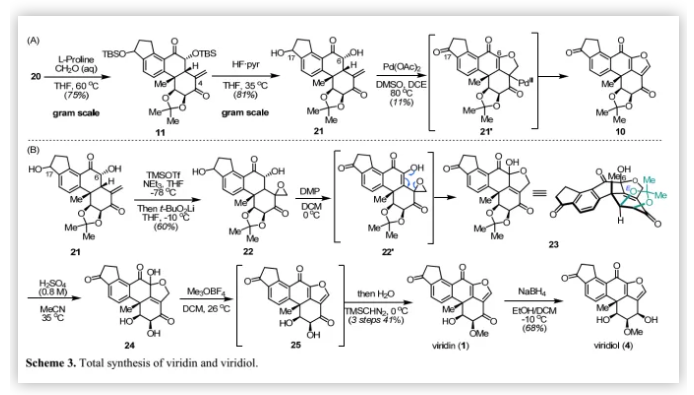
对于(-)-viridin和(-)-viridiol的合成,作者尝试通过在C-4位进行增加一个碳单位的同系化构建多取代呋喃环,但该方法对高度氧化的D环不可行。经过广泛的研究,作者发现烯胺化学是有效的(Scheme 3A)。在甲醛存在下,用L-脯氨酸处理20得到不饱和酮11(75%),再脱保护得到21(81%)。随后,作者研究了钯催化的脱氢还原和Wacker型环化以调节氧化态并构建呋喃E环。经过条件优化后,作者用Pd(OAc)2的1,2-二氯乙烷溶液处理21仅以11%的收率得到预期产物10。作者认为,化合物10的合成可以通过C-17和C-6位羟基的串联脱氢、分子内烯醇-钯化和中间体21'的还原消除实现。随后,将10中的丙酮叉保护基脱除,然后甲基化得到viridin(1)。由于10处于高氧化态,在酸性条件下(BCl3)不稳定;因此,加入甲基化试剂(Me3OBF4)会产生微量的viridin(1)。
接下来,作者通过改变合成策略即利用t-BuO2Li对21的末端烯烃进行环氧化得到环氧化物22(Scheme 3B),其C-6位羟基经Dess-Martin氧化得到五环产物23。作者认为活性四羰基中间体22'以烯醇形式存在可以促进环氧开环和半缩酮化,从而得到呋喃E环。在H2SO4作用下,脱除23中丙酮叉保护基得到的顺式二醇24在碱性条件下的极度不稳定性,作者选择在离子交换树脂上淬灭反应,然后浓缩洗脱液得到粗品24;其与Me3OBF4反应得到脱水产物25,但是其甲基化速度很慢,需加入TMSCHN2加速甲基化,最终以3步41%的收率得到viridin(1);随后,用硼氢化钠选择性还原C-3位羰基以68%的收率得到viridiol(4)。作者合成的化合物1和4的1H、13C NMR和HR-MS数据与Sorensen和Guerrero等人报道的数据一致。
(图片来源:J. Am. Chem. Soc.)
总结:华东师大高栓虎教授课题组以市售的L-核糖为起始原料分别经17和18步反应完成了呋喃类甾体天然产物viridin和viridiol的不对称全合成。合成亮点:1)通过分子内腈氧化物-烯烃环加成构建具有关键手性顺式三醇片段的高度取代的D环;2)利用钴催化的MHAT自由基环化在C-10位构建C环和季碳手性中心。此外,作者开发的新合成策略可以用于生源相关的天然产物及其类似物的全合成,从而用于药物化学和生物学研究。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn