

唾液酸广泛存在于糖蛋白及糖脂,在细胞相互作用、病原体—宿主识别中起关键作用。唾液酸中,N-乙酰神经酰胺(Neu5Ac)在自然界中通过α-(2,3),α-(2,6)糖苷键与半乳糖或半乳糖胺相连,或通过α-(2,8),α-(2,9),或交替的α-(2,8)/α-(2,9)糖苷键同聚。由于羧基的吸电子特性、季碳的异头位中心及3-位羟基的缺失使立体选择性地唾液酸化十分困难。传统方法,包括替换异头位的离去基团,引入新保护基,调控C-5氨基的电子效应等,存在底物适用性窄、选择性对温度敏感等缺点。因此,为满足化学生物学发展需求,新型的唾液酸化方法依然有待发展。
叠氮基团多样的反应活性使C-5叠氮唾液酸砌块能满足多样化合成唾液酸分子的需求。然而,即使在氰基效应的影响下,该类砌块仍无法立体选择地生成糖苷键。但是,叠氮的强吸电子特性可以将异头位氧鎓离子去稳定化,提高中间体通过邻基参与过程反应的可能性。Pic基团已被广泛用于唾液酸合成,其不仅可作为邻基参与基团,也可作为氢键受体与糖基受体作用,此外,在Pic保护的唾液酸硫苷给体被活化时,曾有糖基OTf酯中间体产生的报道,其为糖苷化SN2型反应的重要中间体。江西师范大学孙建松研究员等人因此设计了5-叠氮-1-(2′-Pic)-唾液酸硫苷给体并将其用于唾液酸化,该给体的反应体现了优异的α-选择性。作者通过实验及理论计算明确了反应机理并首次确证了唾液酸1-位吸电子取代基对糖苷化立体选择性的影响,相关成果发表在Angew. Chem. Int. Ed.上。
作者首先对糖基给体进行了合成(Scheme 1.),由1出发,在LiCl、吡啶条件下经Krapcho脱甲基后,在碱性条件下与PicBr发生酯化反应以2步80%收率得到给体2。

图片来源:Angew. Chem. Int. Ed.
作者对后以2和3的糖苷化反应为模型反应进行条件优化(Table 1.),其中,HOTf的量对反应有关键影响,将酸增加至1.0当量后,反应以高收率得到偶联产物(entry 3)。值得一提的是,反应的立体选择性与酸的量无关。当以2α为给体时,尽管收率略降低,但该给体活性高、反应时间缩短(entry 4)。

图片来源:Angew. Chem. Int. Ed.
得到最优条件后,作者对伯醇受体进行了扩展(Table 2.),苄醇5、葡萄糖6-8均以高收率和α-选择性完成糖苷化,8由于苯甲酰基电性的影响,需要高温(-20 到 -10 oC)并延长反应时间(4 h)完成反应。2-叠氮-2-脱氧葡萄糖、甘露糖和半乳糖(9-11)6-位也能完成糖苷得到9-11。其中,邻碘苯氧基(IP)作为MPEP的掩蔽形式,在该条件下是惰性的,为后期合成天线分子奠定了基础。
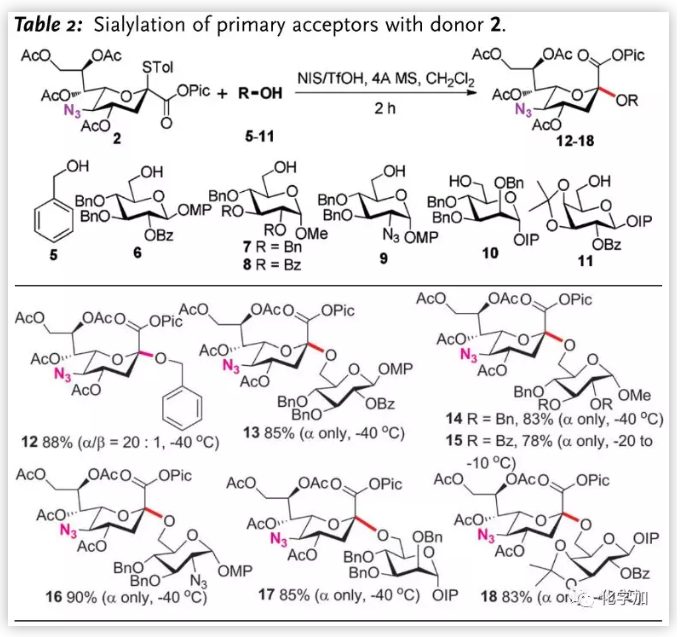
图片来源:Angew. Chem. Int. Ed.
二级或三级羟基与唾液酸给体在糖苷化过程中,往往使用多个羟基裸露的受体以缓解位阻效应。而为验证发展的糖苷化反应效率,作者尝试了一系列单羟基裸露受体(Table 3.)。受限于弱亲核性,除环己醇19和armed受体20外,其他受体的糖苷化反应均需升温至-20 oC,但该变化不会影响立体选择性。半乳糖受体23给出低收率的糖苷化产物31(42%),但将其4、6-位保护基换为苄叉后,收率提升(73%)。与Crich观察的β-选择性不同,作者以3:1的选择性得到L-鼠李糖的α-唾液酸化产物。三级羟基金刚烷醇26同样能以完全的α-选择性得到糖苷化产物34。
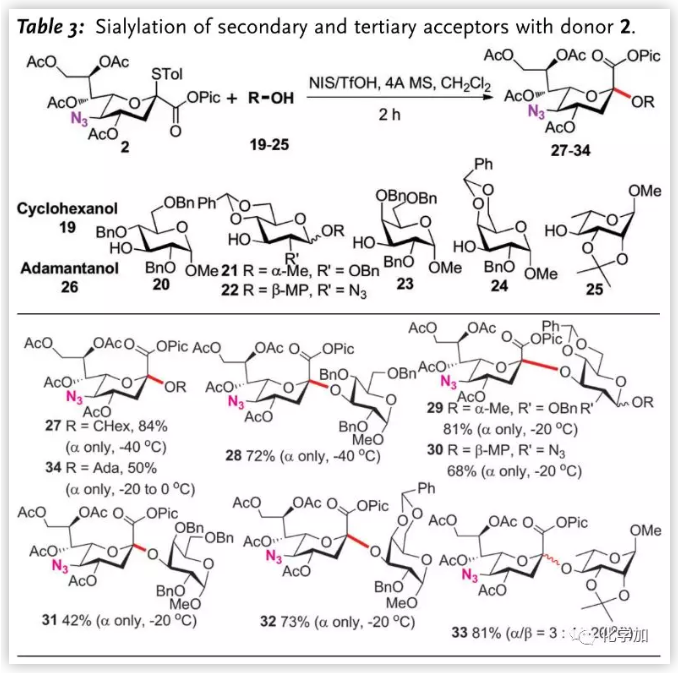
图片来源:Angew. Chem. Int. Ed.
Neu5Ac的α-(2,8),α-(2,9)连接广泛存在于糖蛋白中,但由于唾液酸8、9-位羟基的极弱亲核性使该键成为最具挑战性的糖苷键之一。作者尝试使用该方法形成唾液酸α-(2,8),α-(2,9)糖苷键(Scheme 2.),在标准条件下,给体2与受体35及36能以完全的立体选择性得到二糖37和38。

图片来源:Angew. Chem. Int. Ed.
作者随后尝试脱除糖苷化产物的Pic基团(Table 4.)。在二氯甲烷/甲醇中,以Cu(OAc)2为螯合剂,无反应发生。将溶剂换为纯甲醇并将温度升高,作者成功以高收率将唾液酸二糖Pic酯转化为甲酯,而底物中的其他基团不受影响。
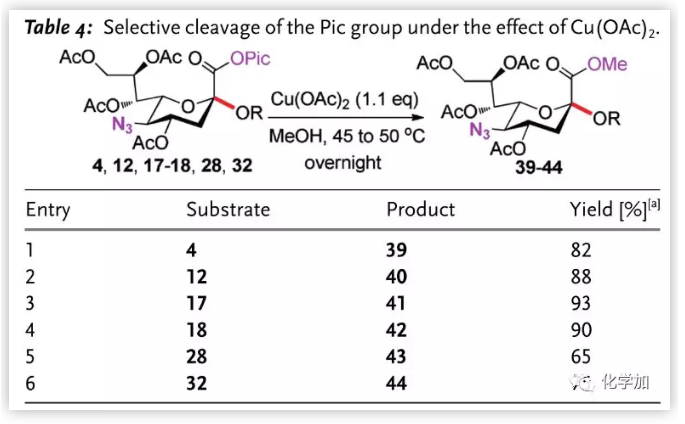
图片来源:Angew. Chem. Int. Ed.
除Pic酯外,作者还对叠氮进行了转化(Scheme 3.),在硫代乙酸与吡啶的存在下,14和42中的叠氮被顺利转化为自然界中存在的氨基乙酸;而为了将叠氮转化为其他酰基,作者引入了试剂47,并分别将39和40中的叠氮转化为苄氧乙酰基。
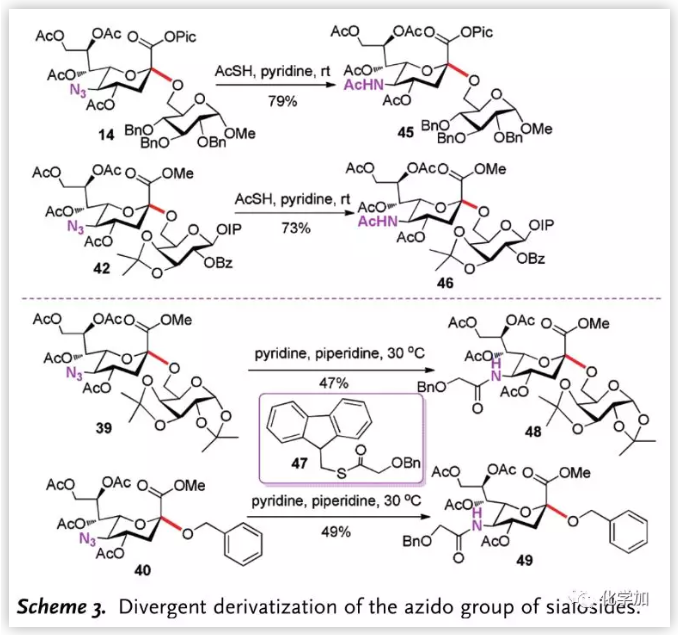
图片来源:Angew. Chem. Int. Ed.
作者随后结合此糖苷化反应与之前发展的MPEP“掩蔽—活化”策略并将其用于天线分子的合成。由2出发,其与半乳糖IP受体50发生糖苷化反应,以90%, α-选择性得到二糖,将Pic和叠氮基团转化后,通过Sonogashira反应将IP转化为MPEP给体,随后与55发生糖苷化反应,以83%收率得到三糖;再一次去掩蔽化将IP转化为MPEP后与甘露糖58发生糖苷化反应,最终以7步最长线性步骤,29%总收率得到I型天线分子59。
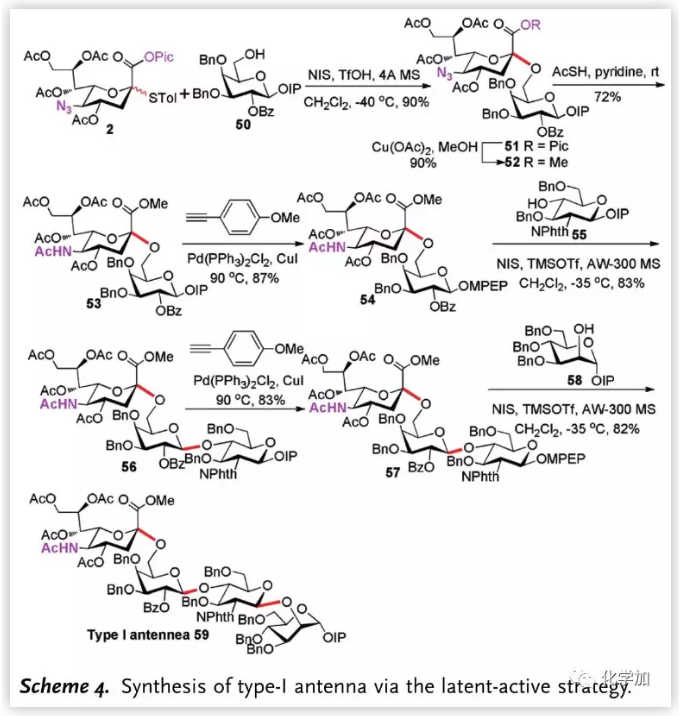
图片来源:Angew. Chem. Int. Ed.
作者随后对II型天线分子进行了合成,给体2与半乳糖受体60区域专一地与3-位羟基发生反应,以α-选择性实现α-2,3糖苷键的构建,接着通过同样的步骤,以最长线性步骤8步16%的总收率完成II型天线四糖的合成。
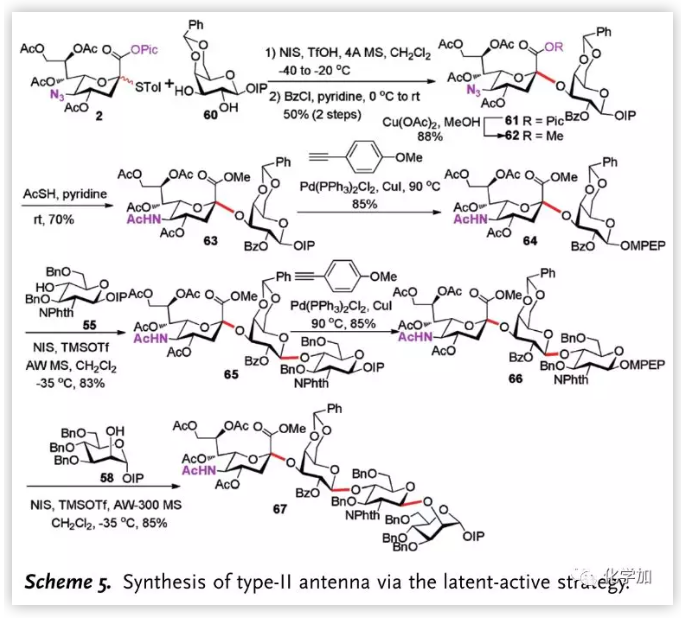
图片来源:Angew. Chem. Int. Ed.
为明确反应机理,查明该糖苷化反应的立体选择性来源,作者比较了1-位Pic给体和OMe给体与不同受体反应的立体选择性(Table 5.),发现OMe给体反应的立体选择性较Pic给体有了极大下降,表明Pic对立体选择性有指导作用。

图片来源:Angew. Chem. Int. Ed.
因此,作者提出三种可能的反应机理(Figure 1.)。2被活化后,氧鎓离子在a途径中与Pic酯直接通过邻基参与生成II,随后与受体发生SN2反应得到糖苷化产物;b途径中,硫苷被活化离去后,Pic迅速质子化生成III,III与HOTf反应生成β-OTf酯IV,发生SN2反应生成产物;c途径中,氧鎓离子率先接受Pic基团进攻生成II及II′,随后在当量的HOTf作用下生成OTf酯中间体接受亲核进攻以SN2(类SN2)机理生成α-糖苷键。

图片来源:Angew. Chem. Int. Ed.
作者接着进行了详细的对比实验(Table 6.)。其通过entry1-3的结果排除了途径a;entry 4-7证明反应的α选择性随1-位保护基吸电子能力提升;随后作者通过试剂反加策略证明途径b不适用于β-硫苷的活化,因此途径c是最有可能的反应路径,作者也通过entry 15-17验证了他们提出的假说。在路径c中,中间体IV可能以紧密离子对形式存在,因此无法通过低温核磁直接观察其结构。
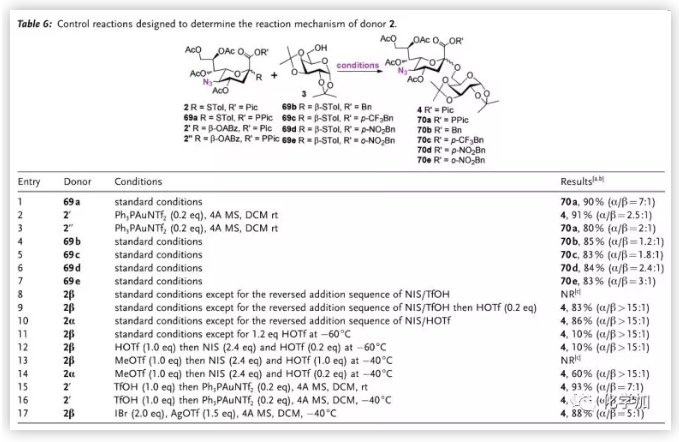
图片来源:Angew. Chem. Int. Ed.
作者也通过DFT计算验证了反应机理(Figure 2.)。其中,IVβ′能量比IIα′及IIβ′低,证明II向IV的转化是热力学有利的;同时,IVβ′比IVα′要稳定,证明了IVβ′是反应的关键中间体,其通过SN2反应生成α-糖苷键。
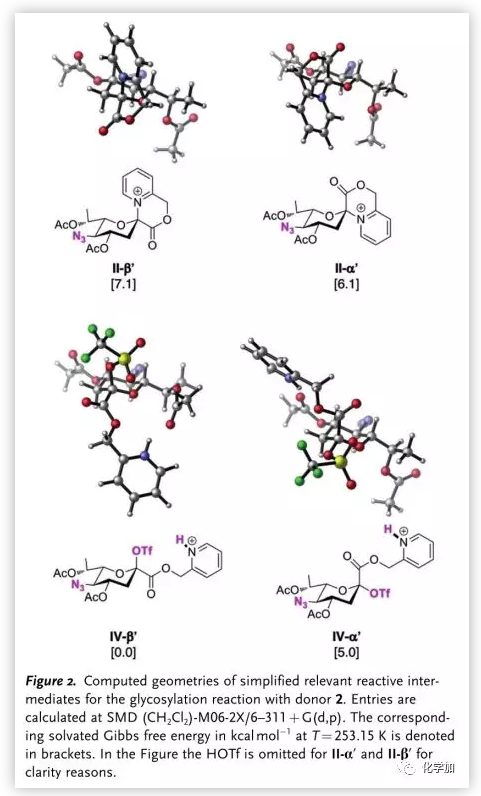
图片来源:Angew. Chem. Int. Ed.
最后,作者通过室温的糖苷化反应和克级反应说明该反应可以满足科研需要(Scheme 6.)。
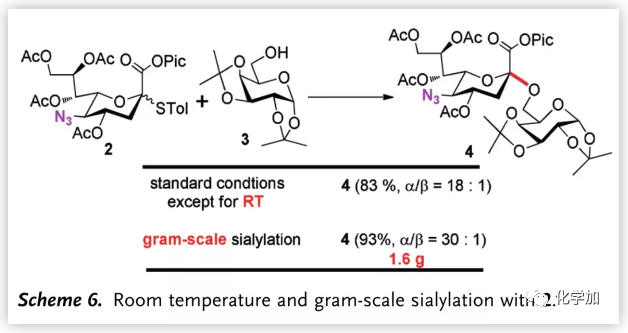
图片来源:Angew. Chem. Int. Ed.
撰稿人:H.D.
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn