NAD(P)H脱氢酶(NQO1) 是一种胞质黄素酶,可以催化醌类化合物的减少以保护细胞免受氧化应激,大量研究发现其在癌细胞中过表达。近年来,利用过表达NQO1的肿瘤细胞激活小分子前药,有效提高了其治疗效果。因此作者设计了一种含有醌丙酸(GPN)的化学配体来修饰蛋白赖氨酸,形成醌和蛋白偶联物。GPN修饰和NQO1催化的GPN去除策略可适用于不同大小的蛋白,包括绿色荧光蛋白(GFP)、细胞色素c (Cyt c)和核糖核酸酶A (RNase A)。此外,GPN修饰Cyt c或RNase A,以及NQO1触发的GPN去除,有效控制了蛋白活性。
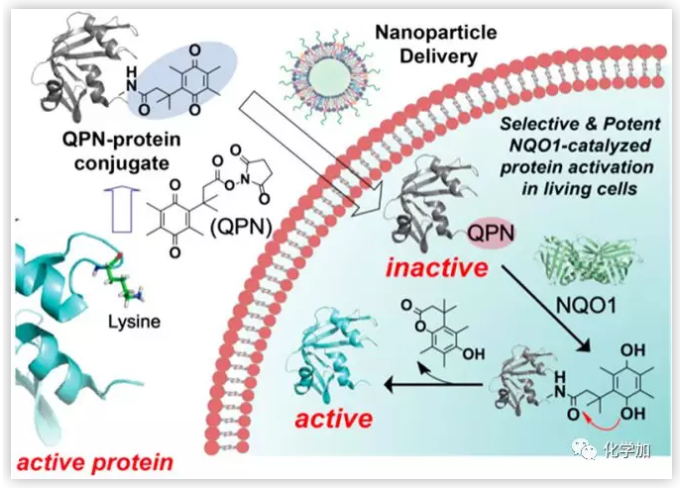
图1. NQO1催化的蛋白质的化学修饰及其在细胞内的传递路径,以激活活细胞中的蛋白质,实现潜在的靶向癌症治疗。(图片来源:J. Am. Chem. Soc.)
作者合成了可与NQO1反应的配体GPN和不含可与NQO1反应部分的对照配体(PN)。首先在0.1 M NaHCO3溶液(pH 9.5)中以1:300的摩尔比将GFP与GPN或PN混合,然后反应6 h,离心纯化,使每个GFP分子平均与7个GPN或PN分子偶联。然而,用NQO1处理GFP-GPN或GFP-PN时,蛋白质的去甲基化结果有很大不同。GFP-GPN(50 μg /mL)与NQO1 (100 ng/mL)孵化可以使GPN有效从蛋白质上去除,而当GFP-PN同样与NQO1孵化时没有观察到PN被去除,说明GPN修饰可以使NQO1特异性去除蛋白质轭合物。
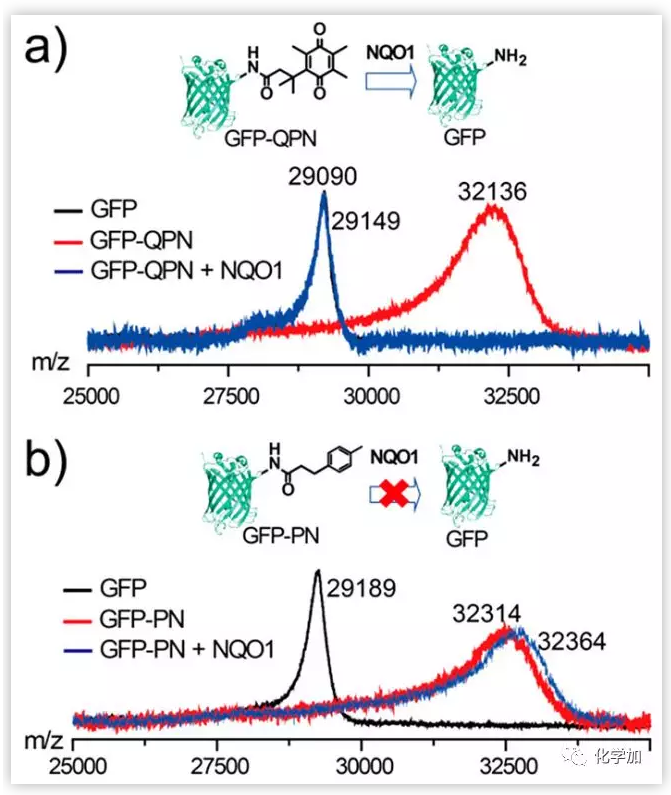
图2. NQO1处理前后GFP-GPN (a)和GFP-PN (b)的MALDI-TOF(基质辅助激光解吸/电离飞行时间质谱分析)质谱表征。(图片来源:J. Am. Chem. Soc.)
接下来,作者研究了Cyt c和RNase A的GPN修饰,以进一步证明该方法在开发NQO1响应蛋白偶联物和利用NQO1控制蛋白活性方面的普遍性。MALDI-TOF分析表明,GPN与上述蛋白混合后,GPN能有效修饰Cyt c和RNase A。通过对RNase A-GPN或RNase A-PN的蛋白水解消化和质谱分析,详细研究了RNase A的修饰位点,发现GPN和PN偶联导致多个赖氨酸残基的修饰,这些修饰降低了蛋白活性。此外,RNase A的GPN或PN修饰对蛋白质构象的影响很小。重要的是,当Cyt c-GPN或RNase A-GPN被NQO1处理时, GPN配体被有效去除。而使用NQO1处理Cyt c-PN或RNase A-PN时均未观察到配体被去除。酶活性测定结果表明,GPN修饰Cyt c或RNase A的赖氨酸明显降低了其活性,而NQO1处理有效恢复了蛋白活性。经修饰的Cyt c- GPN和Cyt c- PN的酶活性降低到约5%。然而,与未和NQO1孵育相比,使用NQO1处理可使Cyt c-GPN活性增加20倍。此外,在NQO1处理下未观察到Cyt c-PN活化。且当两种蛋白都被NQO1处理时,RNase A-GPN表现出NQO1调节的蛋白活性,但是RNase A-PN没有。此外,当Cyt c-GPN或RNase a - GPN在竞争性NQO1抑制剂(如双香豆素)存在的情况下使用NQO1处理时,蛋白激活被显著抑制。
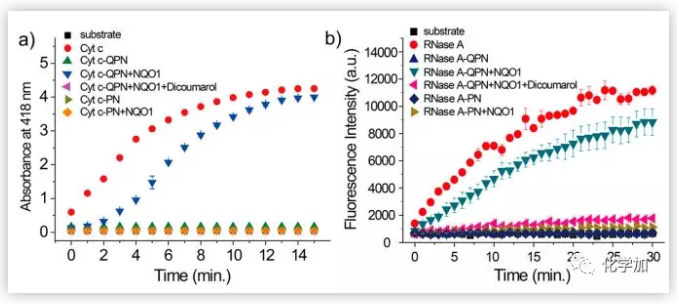
图3.在有无NQO1抑制剂(双香豆素)的情况下,用NQO1处理Cyt c-GPN (a)或RNase A - GPN (b)的酶活性测定。(图片来源:J. Am. Chem. Soc.)
RNase A可以催化细胞内RNA的水解,促进细胞内RNA的死亡。然而,肿瘤细胞特异性NQO1对RNase A-GPN活性的控制由于蛋白进入细胞的低效率而被大大阻碍。因此,将蛋白偶联物导入肿瘤细胞以激活NQO1并进行靶向治疗至关重要。作者合成了一个阳离子脂质库,并通过自组装蛋白质脂质纳米颗粒筛选了有效的蛋白质递送载体。最近,作者证明了将活性氧(ROS)可分裂的硫代乙二胺基转移到脂质纳米颗粒中可以促进细胞内脂质降解和癌细胞内蛋白释放,从而增强基因沉默。作者假设这种ROS增强的递送策略同样适用于递送RNase A-GPN以促进癌细胞内蛋白的释放,使NQO1催化的RNase A-GPN激活。因此作者利用脂质纳米颗粒和RNase A-GPN组成的自组装纳米复合物处理过表达NQO1的HeLa细胞,研究这些脂质传递RNase A-GPN的能力。RNase A-GPN的高效递送及胞内NQO1的激活可抑制肿瘤细胞的生长,因此作者测量了脂质/RNase A-GPN纳米颗粒处理后HeLa细胞的活力,以比较不同脂质处理的蛋白递送效率。
图4. RNase A-QPN的脂质纳米颗粒有效递送的鉴定。(图片来源:J. Am. Chem. Soc.)
为了进一步验证细胞内NQO1在激活RNase A-GPN中的关键作用,作者首先利用RNA干扰(RNAi)在ROS-TK-12/RNase A-GPN递送前敲除HeLa细胞内的NQO1。细胞内NQO1水平的定量和比较结果显示,与未处理的细胞相比,siNQO1处理(80 nM siRNA)使HeLa细胞中NQO1的表达降低了40%。此外,与未处理的细胞相比,siNQO1处理使HeLa细胞中的NQO1活性降低了55%,而阻止siRNA的传递并没有导致NQO1表达下调。siNQO1转染的HeLa细胞用ROS-TK-12 /RNase A-GPN纳米颗粒进一步处理。结果表明,与未转染siNQO1的HeLa细胞相比,转染siNQO1的HeLa细胞对ROS-TK-12/RNase a - GPN的细胞毒性明显降低。由于上述发现,作者进一步研究了NQO1刺激因子萝卜硫素的存在是否能刺激NQO1低表达细胞系HEK293T中RNase a - GPN的激活。结果证明萝卜硫素(1.33 μM)处理HEK293T细胞后细胞内NQO1水平是没有萝卜硫素刺激的细胞的1.6倍。用ROS-TK-12 /RNase A-GPN纳米颗粒处理对HEK293T细胞的细胞毒性很小,因为这些细胞中的低NQO1水平有效阻止了RNase A-GPN激活。然而,将ROS-TK-12/ RNase A-GPN转染到萝卜硫素预处理的HEK293T细胞后,细胞存活率比未处理的细胞降低了25%。
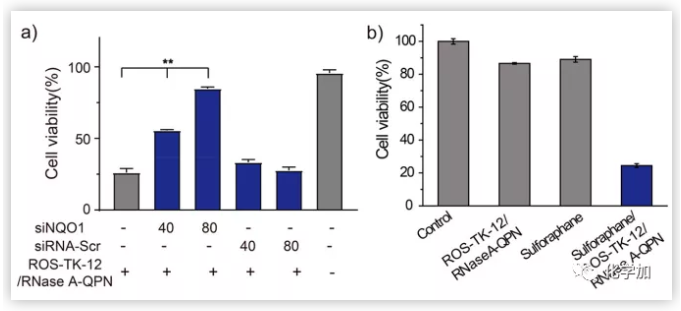
图5.RNA干扰(a)或萝卜硫素刺激HEK293细胞NQO1表达下调(b)有效调控了RNase A-GPN的激活,从而调控了ROS-TK-12/RNase A-GPN纳米颗粒的对细胞的毒性。(图片来源:J. Am. Chem. Soc.)
最后,作者研究了ROS-TK-12/RNase A-GPN纳米粒子的体内递送,以证明其抗肿瘤作用。作者在BALB/c雌性小鼠左侧腋窝皮下注射HeLa细胞,建立了HeLa宫颈癌异种移植瘤模型,再向HeLa荷瘤小鼠体内注射了荧光标记的ROS-TK-12/FITC-RNase AGPN纳米颗粒,对小鼠器官进行荧光成像。给药6小时后,ROS-TK-12/ FITC-RNase A-GPN纳米颗粒在肿瘤部位有效积累。相比之下,FITC-RNase A-GPN注射并未导致任何肿瘤靶向的蛋白递送。作者又在HeLa肿瘤模型中比较了ROS-TK-12/RNase a - GPN纳米颗粒对肿瘤生长的抑制作用,将ROS-TK-12/RNase A-GPN纳米颗粒静脉注射到荷瘤小鼠体内,同时以游离RNase AGPN或ROS-TK-12纳米颗粒作为阴性对照。结果显示,与用磷酸盐缓冲盐溶液(PBS)处理小鼠相比,游离RNase A-GPN或ROS-TK-12注射对肿瘤生长的抑制作用最小。与此形成鲜明对比的是,以每2天一次的频率给药5次ROS-TK-12/RNase A-GPN纳米颗粒(2.5 mg/kg),可抑制肿瘤生长达80%。且与PBS注射相比,ROS-TK-12/RNase A-GPN纳米颗粒治疗小鼠的体重变化可以忽略不计,也就说明该方法具有很高的生物相容性,可用于安全有效的癌症治疗。
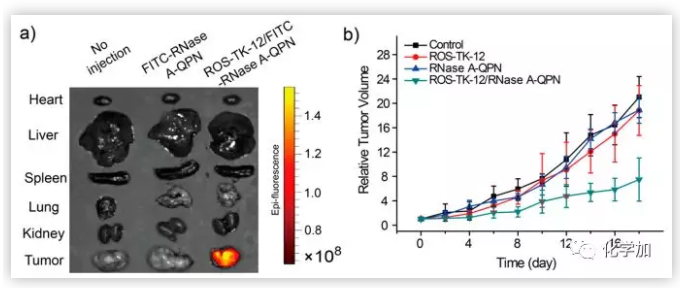
图6.ROS-TK-12/RNase A-GPN纳米粒的体内分布以及不同纳米颗粒处理HeLa荷瘤小鼠的肿瘤生长曲线。(图片来源:J. Am. Chem. Soc.)
总结:中国科学院化学研究所汪铭课题组报道了一种简便和通用的化学方法来修饰蛋白,并选择性地控制NQO1高表达肿瘤细胞中的蛋白活性。通过使用响应ROS的脂质纳米颗粒递送蛋白,证明了NQO1诱导PPT激活对癌症靶向治疗的效力。RNase A-GPN的胞内传递及其随后被NQO1激活,有效地抑制了肿瘤细胞的生长。该方法增加了潜在有用的化学工具的数量,使用疾病细胞特异性酶可逆地控制蛋白质的结构和功能,为动态生物学过程的研究和精确的蛋白质治疗的发展提供了机会。







