

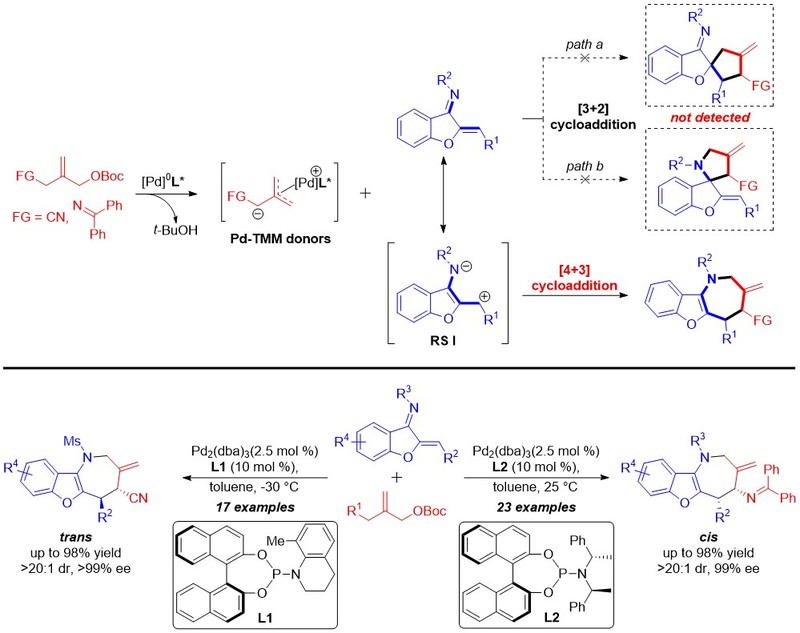
氮杂卓类优势骨架广泛存在于多种药物分子和天然活性化合物中,其高效构建一直是有机合成和创新药物研究中最重要的研究热点之一。[4+3]环加成反应作为构建七元环骨架最直接、高效的手段之一,在现代有机合成领域具有重要应用。然而基于催化不对称[4+3]环加成反应高效合成手性氮杂卓类化合物一直是该领域的重要挑战。
三亚甲基甲烷(TMM)作为一类重要的全碳1,3-偶极子,被广泛用于多种五元环类化合物及天然产物的合成中。然而相较于已经发展的非常成熟的TMM参与的[3+2]环加成反应,其参与的不对称[4+3]环加成反应则未见报道,主要原因在于该反应过程中存在区域选择性及立体选择性调控的难题。为了解决这一科学难题,邓卫平教授团队以橙酮亚胺作为四元氮杂双烯,巧妙地实现了钯催化TMM的不对称[4+3]环加成反应,并且成功抑制了潜在的[3+2]环加成反应过程,实现了高度专一的区域选择性调控,该反应以优秀的收率(84%-98%)、优秀的非对映及对映选择性(9:1- >20:1 dr, 94%- >99% ee)合成了一系列结构多样的手性氮杂卓类化合物。值得注意的是,亚氨基和氰基取代的TMM底物,分别专一的得到了cis和trans构型的环加成产物,从而实现了立体多样性合成。上述工作拓展了催化不对称[4+3]环加成反应的类型,为手性氮杂卓类化合物的高效合成提供了新的思路,从而为创新药物研发提供了重要的分子实体。
该项研究成果主要是由博士研究生刘飏子完成,通讯作者是邓卫平教授和杨武林博士。该项研究得到了国家自然科学基金、上海市青年科技英才扬帆计划、中国博士后科学基金和教育部基本科研业务费探索研究基金等项目的支持。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.201909158.
药学院邓卫平教授团队一直致力于催化不对称合成领域的研究,通过新型手性催化剂和手性配体的设计以及新型催化不对称合成方法的开发,为结构重要的手性分子和手性药物的不对称合成提供了高效便捷的方法,并取得一系列突破性的研究成果(J. Am. Chem. Soc.2010,132, 17041-17044;Angew. Chem. Int. Ed.2011,50, 4897-4900;2016,55, 4527-4531;2019,58, 16119-16123;ACS Catal.2016,6, 652-656;2016,6, 5685-5690;Org. Lett.2011,13, 6010-6013;2015,17, 4822-4825;2015,17, 4988-4991;2018,20, 104-107;2018,20, 3838-3842;2018,20, 4121-4125;2019,21, 1015-1020;2019,21, 5514-5518;Chem. Commun.2011,47, 2961-2963;2015,51, 9212-9215;2019, 55, 7346-7349.)。
杨武林作为邓卫平团队的核心骨干成员,已在国际核心刊物Angew. Chem. Int. Ed.,ACS Catal.,Chem. Commun.,Org. Lett.等上发表近30篇SCI论文,并作为项目负责人主持了国家自然科学基金青年项目(2019)、上海市青年科技英才扬帆计划(2018)、中国博士后科学基金第12批特别资助及第63批面上资助、教育部基本科研业务费探索研究基金等多项研究项目。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn