

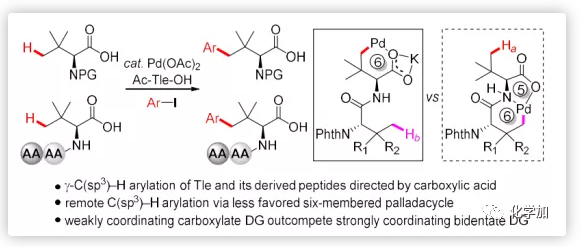
含大体积侧链的氨基酸不仅是许多天然产物和药物中的重要结构片段如Saxagliptin和Asunaprevir等(Figure 1a),还是通过外配位(Figure 1b)或内配位途径(Figure 1c)进行对映选择性C-H官能团化的有效手性配体。最早,Hashimoto课题组将一系列邻苯二甲酰亚胺保护的氨基酸衍生物作为二铑(II)络合物的有效配体用于carbenoid的对映选择性C-H插入。大体积叔亮氨酸(Tle)衍生的催化剂Rh2(S-NTTL)4通常具有最佳的对映体控制,除氨基酸侧链的空间体积外,邻苯二甲酰亚胺保护基的种类在不对称诱导中也起关键作用;Müller和Dauban等人报道1,8-萘甲酰基保护的Tle衍生的催化剂Rh2(S-NTTL)4是进行高度非对映选择性分子间C-H胺化的最佳催化剂;Davies课题组合成了大体积催化剂Rh2(S-PTAD)4和Rh2(S-TCPTAD)4用于carbenoid的不对称C-H插入。最近,邻苯二甲酰亚胺保护的大体积侧链氨基酸也成为Cp*Co(III)-催化的C-H活化的常用手性配体;Cramer课题组报道了手性Cpx Ir(III)/Rh(III)和Phth-Tle之间的强协同效应可以实现膦氧化物的对映选择性C-H官能团化。大体积侧链氨基酸在Cp*Co(III)-催化的C-H活化中也表现出显著的活性;Matsunaga课题组报道了由非手性Cp*Co(III)/双氮原子保护的(S)-H2-BHTL催化的硫代乙酰胺的对映选择性C(sp3)-H酰胺化反应。通过上述研究发现,侧链的体积和保护基的结构都可以显著影响不对称诱导和反应性。然而,大体积氨基酸的有限利用度阻碍了不对称C-H活化的进一步发展。因此,迫切需要开发新的合成策略用以构建含大体积侧链的手性氨基酸。
毫无疑问,通过易得的大体积叔亮氨酸的直接官能团化可以快速实现氨基酸空间体积的增加,这可能在不对称反应中得到广泛的应用。尽管利用共价连接的外源导向基团(DG)对脂肪族羧酸衍生物进行直接官能化已经开展了充分的研究,但是由于羧基的弱导向能力导致的低反应性,在不引入外源DG情况下进行羧酸的脂肪族C-H键直接转化仍然充满挑战。最近,余金权等人报道了经由动力学稳定的五元钯环过渡态进行的钯催化游离羧酸的β-C(sp3)-H官能团化。然而,利用弱配位羧酸盐DG经由六元钯环过渡态进行远程C(sp3)-H功能团化尚未报道。近日,浙江大学史炳锋课题组报道了钯催化的羧酸盐导向的γ-C(sp3)-H芳基化,可以通过热力学不稳定的六元钯环合成各种大位阻氨基酸(Figure 1d)。
(图片来源:Chem. Sci.)
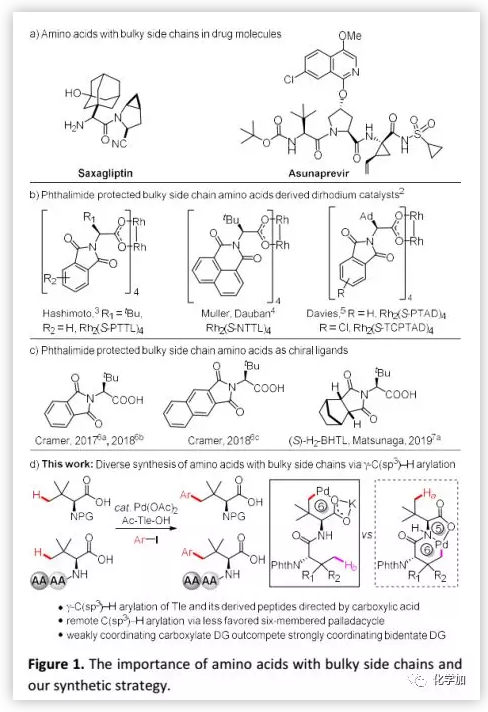
首先,作者以Phth-Tle-OH(1)与1-碘-4-甲氧基苯(2a)为模型底物筛选了一系列氮原子单保护的氨基酸配体,并发现以Ac-Tle-OH为配体时可以15%的收率得到芳基化产物3a。作者假设,Ac-Tle-OH中的大体积侧链在反应中具有促进作用。随后,作者通过对添加剂筛选发现:Ag3PO4可以促进反应使芳基化产物3a的收率提高至40%,Ag3PO4可能发挥双重作用(卤化物清除剂和异核活性物质利于C-H裂解)。通过对反应温度的考察发现,反应温度为70 ℃时最佳。当用3 e.q. 2a时,得到单芳基化产物3a(56%)和二芳基化产物3a'(15%);当以D-Ac-Tle-OH为配体时,结果类似(3a,57%;3a',14%)。最终,作者确定了以下1与2a之间的γ-选择性芳基化条件(Conditions A):10 mol% Pd(OAc)2、30 mol% Ac-Tle-OH、1.0 e.q. K2CO3、1.0 e.q. Ag3PO4,在70 ℃ HFIP溶剂中敞口反应24 h。
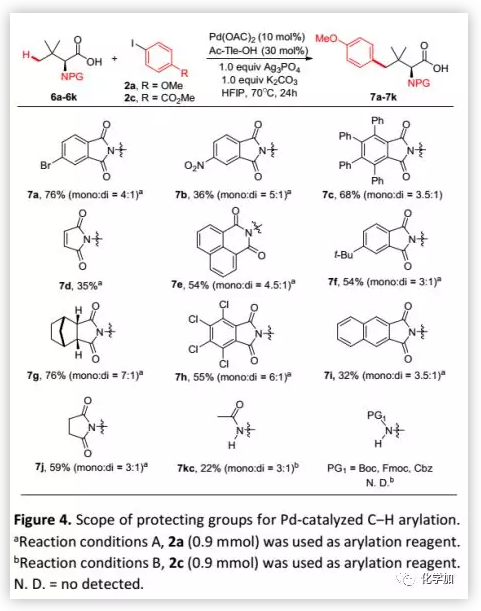
在确定最佳反应条件后,作者考察了芳基碘化物的适用范围(Figure 2)。在最佳反应条件下,含有吸电子基和给电子基的底物均可以良好的收率得到预期产物;在芳基碘化物的对位或间位可以耐受吸电子基团,例如乙酰基、甲氧羰基和甲酰基等;多取代的芳基碘化物也可以进行反应并以中等收率得到预期产物。此外,在最佳反应条件下,Phth-Ala-OH的β-C-H芳基化反应顺利得到β-芳基化产物(51%)。
(图片来源:Chem. Sci.)
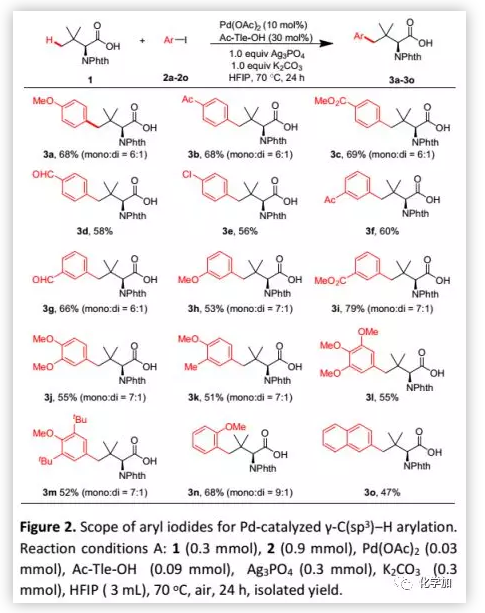
最近,过渡金属催化的C-H活化已成为进行结构复杂多肽后期修饰的最有效策略之一。然而,多肽的C(sp3)-H官能团化主要取决于二齿DGs或多肽骨架的双重配位。作者发现,在稍加改进的条件(Conditions B:Ag2SO4代替Ag3PO4)下,本方法对多肽是可行的:含有甘氨酸、环己甘氨酸和亮氨酸的二肽与2c顺利反应并以中等收率得到芳基化产物。余金权课题组报道了多肽骨架的N,O-或N,N-双配位作用下多肽中N端氨基酸的C-H活化。值得注意的是,弱配位的羧酸DG优于多肽骨架的强配位双齿DG,并且选择在Tle残基的γ-C(sp3)-H键反应(Figure 3b)。此外,该方法也可以耐受三肽,但由于N,N-双配位的竞争配位,使得收率较低(5g,34%;5h,23%)。其特殊的选择性可能源于六元钯环比5,6-稠合双环更容易形成(Figure 3b,Int-A1 vs Int-B1; Int-A2 vs Int-B2)。当N-Phth-Ala-Tle-OH(4i,N端含有丙氨酸残基的二肽)作为底物时,芳基化选择性地发生在N端的β-甲基上。这种选择性与余金权的报道一致,后者通过N,O-双配位形成五元钯环比通过单齿羧酸盐DG形成六元钯环更有利(Figure 3c,IntB3 vs Int-A3)。
(图片来源:Chem. Sci.)
考虑到邻苯二甲酰亚胺保护基在不对称反应中具有重要影响,该方法需要与多种邻苯二甲酰亚胺具有很高的兼容性。因此,作者考察了其他保护基在羧酸盐导向的γ-C(sp3)-H芳基化反应中的耐受性(Figure 4),发现各种邻苯二甲酰亚胺与均该反应相容并可以中等至高收率得到芳基化产物7,特别是可以耐受多种用于不对称C-H活化的邻苯二甲酰亚胺如1,8-萘甲酰基(7e)、7g、四氯邻苯二甲酰基(7h)、2,3-萘甲酰基(7i)。琥珀酰亚胺保护的Tle(6j)也可以参与反应并以59%的收率得到预期产物7j。此外,Ac-Tle-OH也可以较低收率生成预期产物7kc(22%,mono: di = 3:1)。然而,烷氧羰基保护基如Boc、Fmoc和Cbz等不耐受该反应条件。
(图片来源:Chem. Sci.)
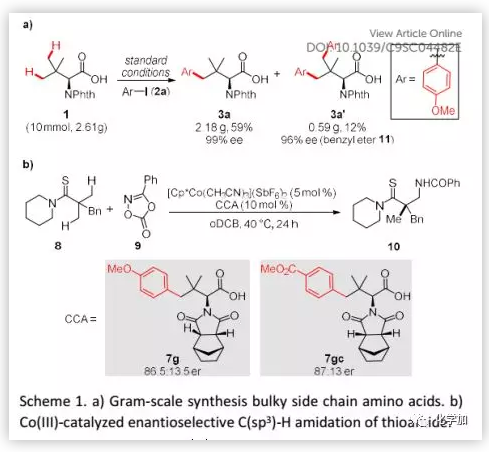
为了证明该方法的实用性,作者进行了3a的克级规模合成(Scheme 1a):1和2a反应以59%的收率得到3a(2.18 g)和12%的收率得到3a'(0.59 g),而没有光学纯度损失,这是作为手性配体应用的前提和必要条件。最后,作者通过使用所得的含大体积侧链氨基酸作为手性配体进一步证明了该方法的实用性(Scheme 1b)。硫酰胺8与二噁唑酮9之间Co(III)-催化的C(sp3)-H酰胺化实验结果表明,7g和7gc反应效率高且具有良好的对映体控制(7g,86.5:13.5 er;7gc,87:13 er;(S)-H2-BHTL, 87:13 er7a)。这些结果表明,修饰的氨基酸在不对称反应中具有很高的潜力,特别是考虑到保护基片段和芳基骨架这两个位点易于多样化修饰。
(图片来源:Chem. Sci.)
小结:浙江大学史炳锋课题组开发了一种钯催化的羧酸盐导向的γ-C(sp3)-H芳基化方法用于大量合成大体积侧链的氨基酸和多肽,该方法是首个使用弱配位导向基团进行多肽的后期C(sp3)-H官能团化的案例。此外,通过该方法所得的含有大体积侧链的氨基酸已成功用于不对称C(sp3)-H活化中的手性配体。
撰稿人:爽爽的朝阳
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn