

(图片来源:J. Am. Chem. Soc.)
杂双环八氢异吲哚骨架普遍存在于天然产物和药物中,如治疗Ⅱ型糖尿病口服降糖药米格列奈(Mitiglinide),治疗慢性瘙痒症的Serlopitant和抗精神病药物哌罗匹隆(Perospirone)(Figure 1a)。因此,一些高效、选择性的方法已被开发用于制备此类骨架。该类方法包括1,6-烯与烯烃或炔的[2+2+2]环加成,含烯或炔基乙烯基环丙烷的环加成,两者均由铑催化完成。但是,由于这些金属催化环加成反应对空间和电子要求较高,导致无法获得多种八氢异吲哚衍生物。
(图片来源:J. Am. Chem. Soc.)
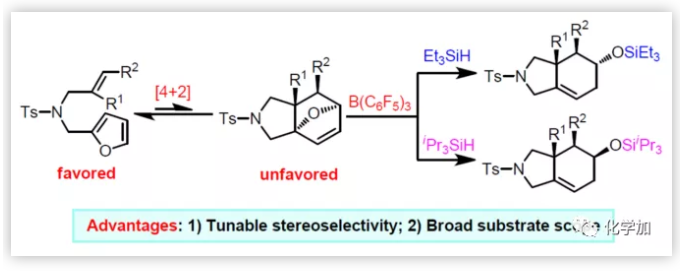
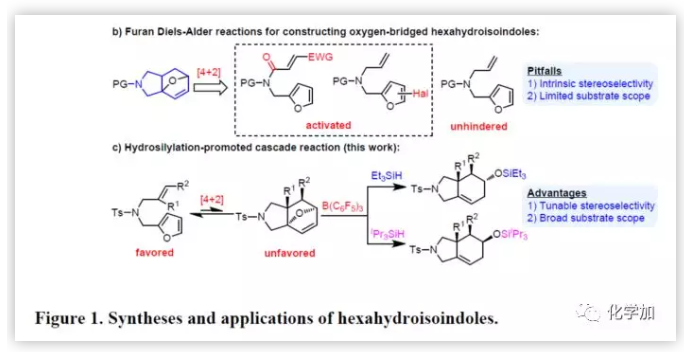
最近,作者通过N-烯丙基-N-糠酰胺作为底物,实现了分子内呋喃Diels-Alder反应,一步合成了氧桥联的六氢异吲哚衍生物(Figure 1b),这些含有氧桥键和烯烃基的产物可进一步作为其它反应的底物。尽管这种方法早已为人所知,并且已经得到充分研究,但底物范围仍然受到限制。活化基团(含卤素的呋喃环或含吸电子基团的烯烃)通常是反应所必需的。未活化底物的环加成反应是可逆的,即使是无空间位阻的单取代末端烯烃底物也可以进行Diels-Alder逆反应,从而再生原料。另外,未活化的非末端烯烃通常是不反应的。更重要的是,未活化的底物(如羰基)与催化剂缺乏缔合,使得外部控制立体选择几乎不可能。在此,南开大学王晓晨研究员课题组报道了,可将底物范围扩大到包括多位阻亲二烯体的呋喃Diels-Alder反应,涉及硼烷催化的氢化硅烷化串联过程(Figure 1c)。出人意料的是,通过改变硅烷基可实现立体选择性控制,对照实验和计算研究表明,硅烷基的空间体积决定了反应机理途径。
(图片来源:J. Am. Chem. Soc.)
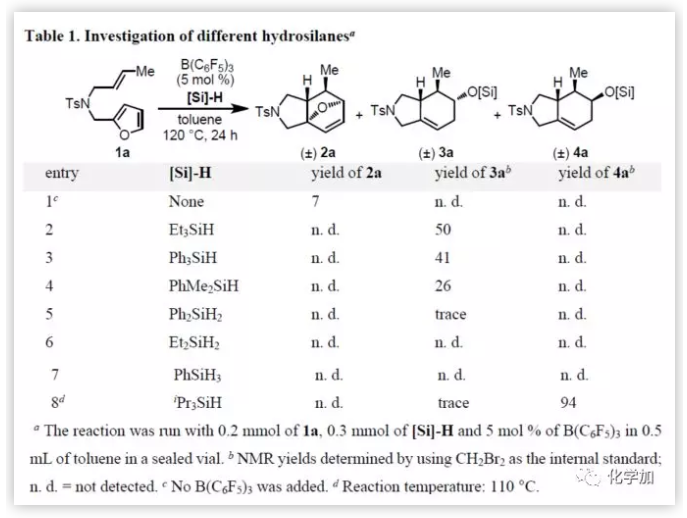
首先,作者以呋喃1a作为模型底物对反应条件进行了筛选(Table 1)。反应结果表明,在无催化剂时,当1a在甲苯中以120 ℃加热12小时,仅获得7%收率的Diels-Alder产物2a,剩余均为未转化的底物(entry 1)。而在Et3SiH和B(C6F5)3催化条件下,环加成/醚断裂串联反应即可发生,得到产率为50%的六氢异吲哚3a(entry 2),剩余的则为原料分解产生的未知物。该结果证实,醚断裂可将原本不利的[4+2]环加成反应向产物3a平衡。其它氢硅烷(Ph3SiH、PhMe2SiH、Ph2SiH2、Et2SiH2和PhSiH3)均未能提高3a的产率(entries 3-7)。然而,令作者惊讶的是,当测试iPr3SiH时(entry 8),反应获得的产物不是3a而是4a(94%),4a作为3a的非对映异构体,通过NMR和单晶X-射线已确认结构的正确性。此外,所有立体中心都是在呋喃Diels-Alder反应中形成,其选择性仅由底物的电子和空间效应控制,而此筛选结果表明,改变硅烷基也会影响立体选择性的结果。
(图片来源:J. Am. Chem. Soc.)
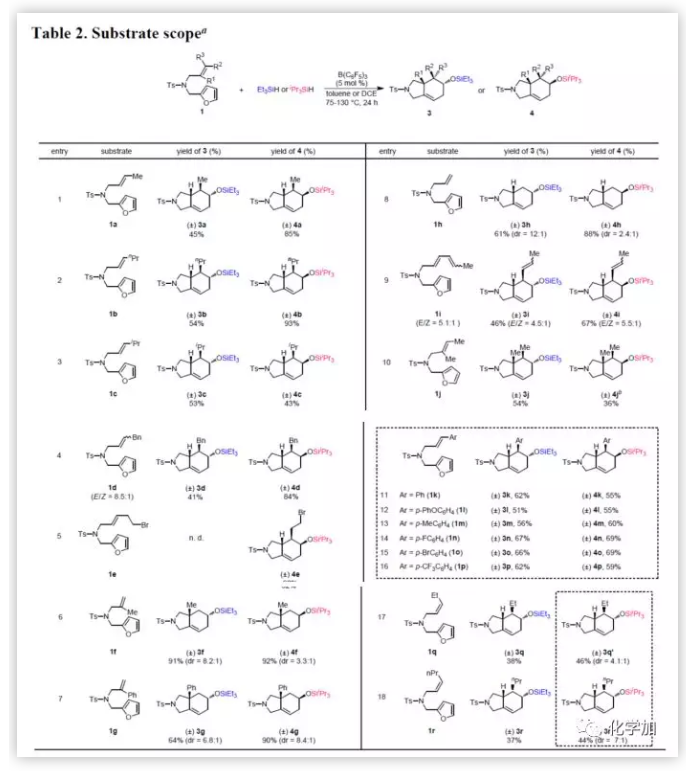
接下来,作者通过多种底物1与Et3SiH或iPr3SiH反应,研究硅烷基对串联反应选择性的影响(Table 2)。1a可与两种硅烷反应,分别获得3a(45%)和4a(85%)(entry 1)。当E-烯烃上的取代基改为正丙基、异丙基或苄基(1b-1d)时,串联反应会根据氢硅烷的不同获得相应的异构体(entries 2-4)。但是,溴乙基取代的底物1e与Et3SiH反应获得复杂的混合物,而与iPr3SiH反应则获得62%收率的4e(entry 5)。此外,1,1-二取代的烯烃1f和1g同样可以进行反应,获得具有手性中心的产物(entries 6-7),这些手性产物(3f、3g和4g)具有良好非对映选择性,但4f的dr相对较低。在选择无空间位阻的底物1h时,作者发现,与Et3SiH反应具有高选择性,而与iPr3SiH反应则表现出较差的选择性(entry 8)。具有共轭二烯(1i)的底物,近端烯烃优先发生环化,得到六氢异吲哚3i和4i(entry 9)。令作者惊讶地的是,对于具有多位阻的三取代烯烃的底物1j同样可以取得较好的结果(entry 10)。此外,芳环上取代基不受电子效应影响,一系列带有末端芳基的底物(entries 11-16)均能顺利的反应。有趣的是,当使用含有Z-烯烃的底物与Et3SiH和iPr3SiH反应,获得与产物相同的非对映异构体(entries 17-18)。
(图片来源:J. Am. Chem. Soc.)
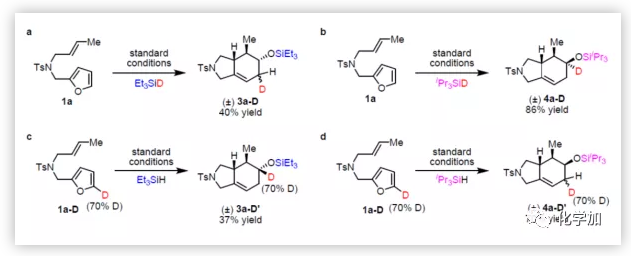
为了研究反应机理,特别是硅烷基控制选择性的起源,作者进行了多组对照实验(Figure 2)。首先,使Et3SiD与1a在标准条件下反应,Et3SiD中的氘被转移到环己烯的烯丙基位置(Figure 2a),表明烯烃中氢化物加成与Diels-Alder环加成中间体已经产生。相反,iPr3SiD的氘被转移到与甲硅烷氧基相连的碳上(Figure 2b),说明4a可能是酮氢化硅烷化的产物。接下来,作者在5-位上用氘标记呋喃,氘代1a与Et3SiH反应后,氘仍处于该位置(Figure 2c),但使用iPr3SiH时,氘转移到相邻的碳上(Figure 2d)。这些实验表明,该反应是通过两种不同的途径进行。作者推测,Et3SiH的反应可能涉及呋喃Diels-Alder环加成反应和醚断裂串联过程,而与iPr3SiH的反应可能涉及1,2-氢迁移和酮氢化硅烷化的过程。
(图片来源:J. Am. Chem. Soc.)
此外,呋喃Diels-Alder环加成反应生成的中间体,可对机理的正确性进行进一步的验证。因此作者从无空间位阻的底物1h着手,合成环加成中间体2h。底物2h与Et3SiH在80 ℃下反应1小时获得83%收率的串联产物3h(Figure 2e),而与iPr3SiH反应仅获得9%收率的4h,而酮5则为主产物(Figure 2f)。此外,2h在B(C6F5)3催化下80 ℃加热1小时,获得90%收率的5(Figure 2g)。这些结果表明,与iPr3SiH的串联反应是经酮5中间体(由B(C6F5)3促进2h开环产生)。5与iPr3SiH在一当量的B(C6F5)3催化下反应1小时,获得77%收率的4h(Figure 2h),其选择性与串联反应所观察到的结果相同(Table 2, entry 8)。然而,当使用催化量的B(C6F5)3时,获得收率极低的4h以及未反应的原料(Figure 2i)。这些结果表明,相对于催化剂而言,过量5会抑制氢化硅烷化反应,可能是因为5与iPr3SiH和B(C6F5)3的配位时存在竞争关系。因此,在1h与iPr3SiH的串联反应中,5的浓度必须保持较低。另一组对照实验中,作者发现,5与Et3SiH反应,生成了非对映异构体混合物(Figure 2j)。考虑到1h与Et3SiH串联反应表现出优异的非对映选择性(Table 2, entry 8),作者得出结论,与Et3SiH的串联反应,仅通过氧桥的硅烷基化断裂进行,而不是通过酮中间体的氢化硅烷化进行。
(图片来源:J. Am. Chem. Soc.)
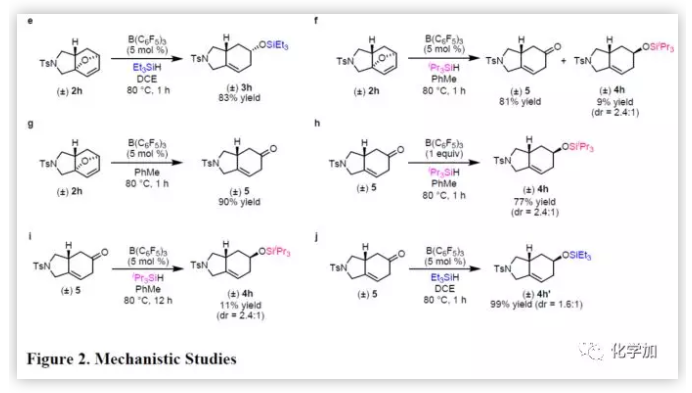
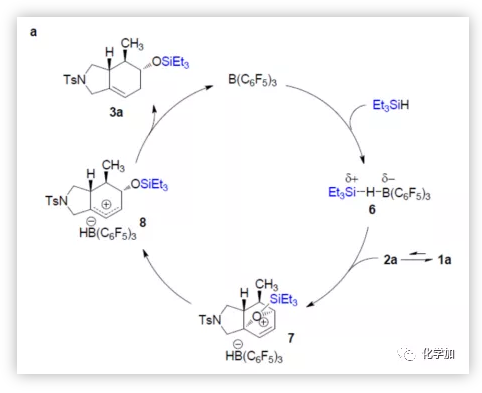
基于上述实验结果,作者首先提出底物1a与Et3SiH反应机理(Figure 3a)。在1a与Et3SiH的串联反应中,环加成中间体2a与硼烷活化的氢硅烷络合物6反应,得到离子对7(硅烷基离子与氧桥键合),随后开环并将负氢转移至烯丙基碳正离子8上,从而获得产物3a,并使催化剂再生。
(图片来源:J. Am. Chem. Soc.)
随后,作者提出了底物1a与iPr3SiH反应的机理,涉及两个催化循环过程(Figure 3c)。在循环A中,B(C6F5)3与2a的氧桥结合形成络合物9,经醚键断裂产生两性离子中间体10,再经1,2-氢迁移得到硼烷-酮配合物11。B(C6F5)3从11上解离生成酮12,该酮进入催化循环B,即硼烷催化的酮氢化硅烷化反应。在此循环中,负氢从HB(C6F5)3-转移至14中位阻较小羰基的一面,从而观察到4a的立体化学特征。
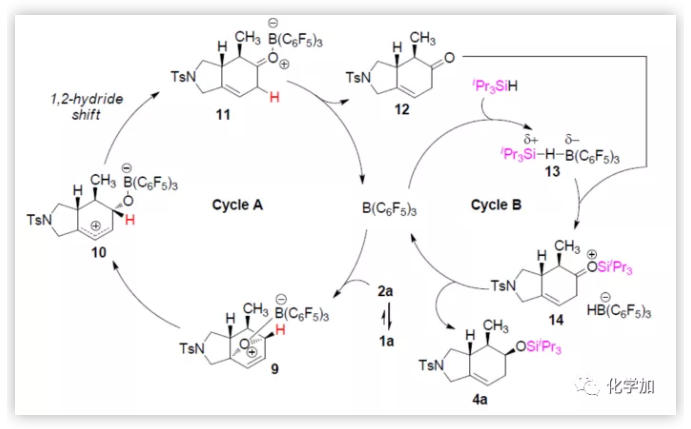
(图片来源:J. Am. Chem. Soc.)
最后,作者通过对4a的后期修饰以证明该方法的实用价值(Figure 4)。如4a与镁反应,很容易去除对甲苯磺酰基保护基,生成游离胺15。而使用m-CPBA氧化烯烃,可获得环氧化物(反式-16和顺式-16)。还可以通过硼氢化氧化获得羟基化合物(顺式17和反式17)。此外,硅烷基可以用TBAF断裂,得到未保护的羟基化合物18(使用PCC氧化得到酮12或在Pd/C上氢化得到顺式-双环八氢异吲哚19,在两种情况下产率都很高)。
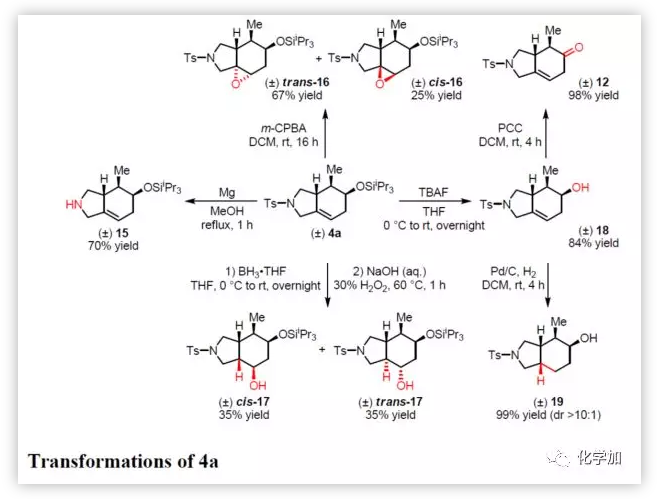
(图片来源:J. Am. Chem. Soc.)
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn