- 首页
- 资讯
西湖大学石航课题组JACS:Ru(II)通过η6-配位催化芳基氟化物的胺化
来源:化学加 2020-02-17
导读:近日,西湖大学石航研究员课题组发展了一种Ru(II)-半不稳定双齿配体催化的芳基氟化物的SNAr胺化反应。反应适用于在传统SNAr反应中惰性的富电子和电中性芳烃,且不需要过量的芳烃。机理研究表明,亲核取代是通过η6-配位进行的,并且半不稳定配体上的弱配位基团促进了芳烃交换步骤。文章DOI:10.1021/jacs.9b13684。
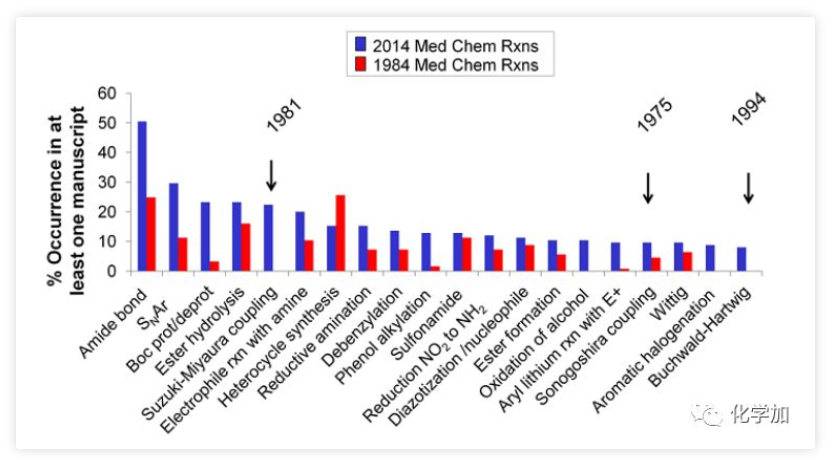
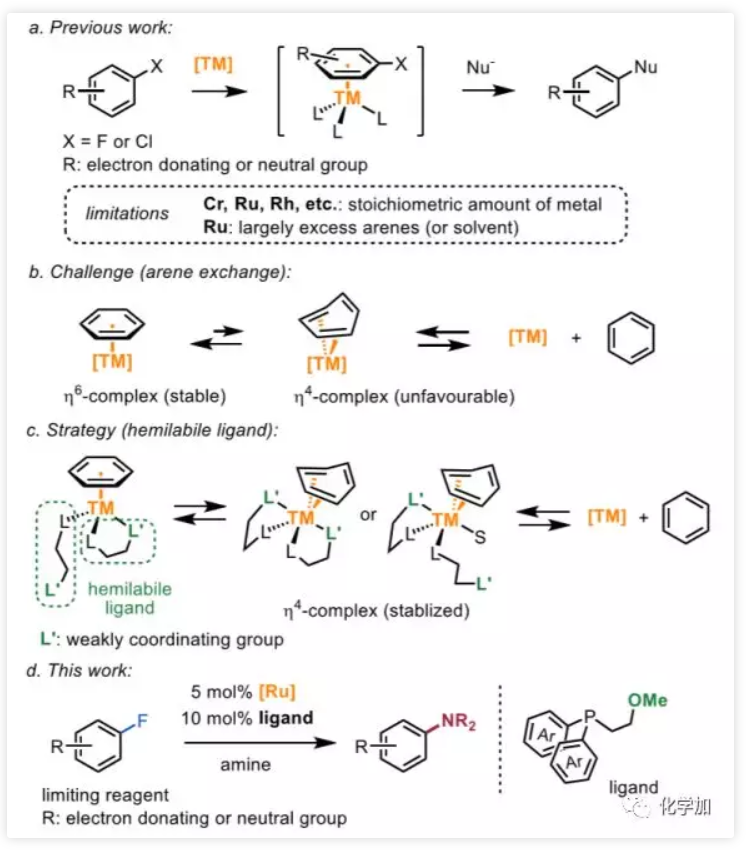
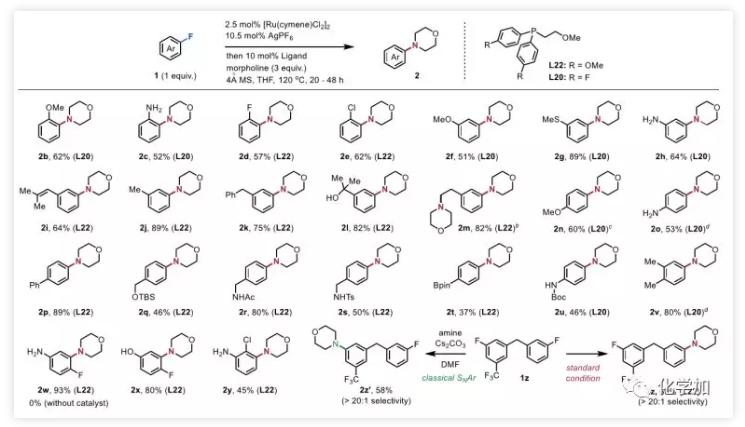
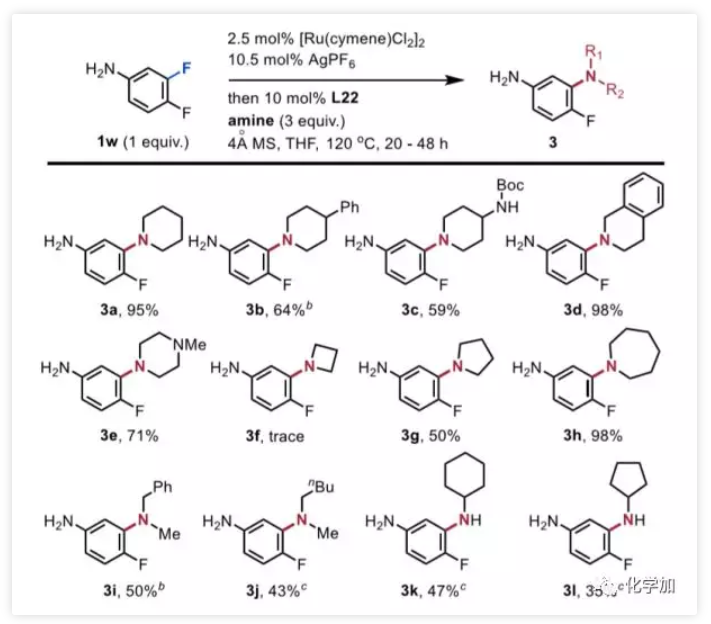
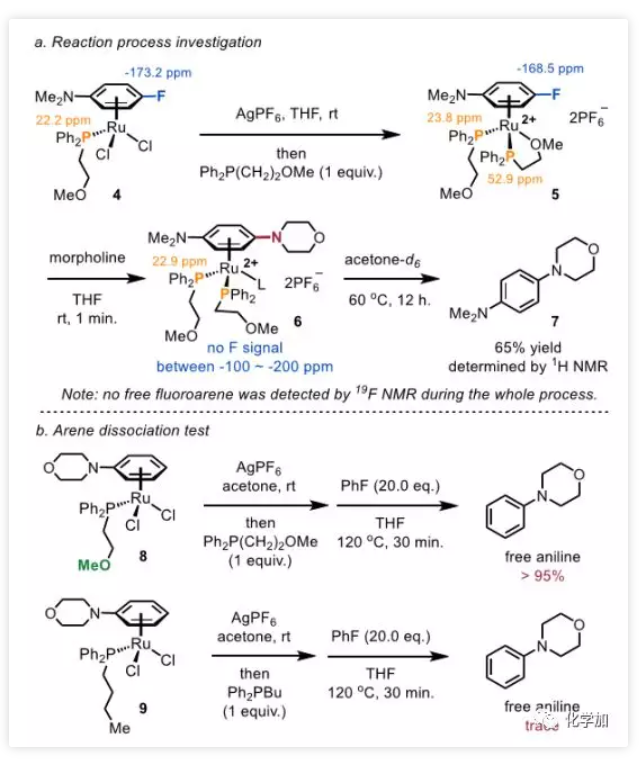
图1. 药物化学研究中的常用有机化学反应(图片来源:J. Med. Chem. 2016, 59, 4443−4458)芳香环作为一类重要的有机分子结构单元,广泛地存在于药物分子之中,因此发展修饰芳环的化学方法,具有重要的意义。芳环亲核取代反应(nucleophilic aromatic substitution reaction,SNAr)是修饰芳基卤代物的有效手段,也是药物化学研究中使用频率仅此于酰胺键形成的有机化学反应(图1,J. Med. Chem. 2016, 59, 4443−4458)。然而经典的SNAr局限于高度缺电子芳烃,为解决底物局限性的问题,化学家们发展了一种极性反转芳香取代(umpolung aromatic substitution)策略,即将芳香环与过渡金属(铬、锰、钌、铑等)制备成η6-配合物,以降低芳环的π电子云密度。该方法使得SNAr反应可兼容电中性和富电性芳环,极大地拓展了适用范围。然而,通过η6-配位活化芳环目前局限于使用当量的过渡金属配合物,仅有少数几例使用大过量的芳基卤化物的催化实例报道,以富电子或中性芳基氟化物作为限制性试剂(limiting reagents)的过渡金属催化的SNAr反应仍有待开发。 图2. 通过η6-配位的SNAr反应(图片来源:J. Am. Chem. Soc.)通常,极性反转芳香取代包括芳烃η6配位、所得η6-配合物的亲核芳香取代和产物解离三个步骤。在催化过程中,底物配位和产物解离统称为芳烃交换,芳烃交换的速率显著影响着催化效率。阻碍芳烃交换速率的重要因素之一为芳烃-金属配合物从稳定的η6配位变成不稳定的η4配位这一不利过程(图2b)。在观察到诸如THF和环己酮等供体分子有利于芳烃交换之后,化学家在配体上引入了一个作为配体侧链的配位基团,以加快交换速率。但目前尚未有通过该策略发展配体促进的SNAr的报道。为了克服这一障碍,西湖大学理学院石航课题组设想利用半不稳定的双齿配体,它可以通过两种方式促进SNAr催化反应(图2c):1)与TM临时配位的侧链基团L'可以通过空间排斥促进产物解离;2)配体的半不稳定性使其配位有很强的灵活性,侧链既可以发生配位稳定反应中间体,也可以在底物与催化剂配位时解离以减少空间位阻效应。基于上述设计,作者开发了一种双膦-Ru催化的SNAr胺化反应,可转化惰性芳基C-F键,且不需要过量的芳烃(图2d)。 图3. SNAr反应催化剂的开发(图片来源:J. Am. Chem. Soc.)首先,作者选择氟苯1a作为限制性试剂来探索SNAr胺化的可行性(图3)。二氯(对甲基异丙基苯)钌二聚体用作催化剂前体,真实催化剂为阳离子Ru(II)-配体络合物,该阳离子Ru(II)-配体络合物是通过Ag促进的脱氯作用和随后的配体配位形成的。作者首先研究了与几种代表性配体的反应条件,例如环戊二烯基阴离子(Cp,L1),N-杂环卡宾(NHC,L2)和联吡啶(L3),均未得到胺化产物2a。然后,作者测试了膦配体,并在单齿三苯基膦(L4)或二苯基丁基膦(L5)的条件下检测到了痕量2a。按照作者的设计,当使用带有甲氧基侧链的半不稳定的膦配体(L6)时,收率显著提高(42%)。改变侧链的长度、柔性(L7,L8,L9)或螯合原子氧周围的空间环境(L10,L11,L12)会降低收率,甚至抑制反应。考察了一系列更强的供电基团如硫醚(L13)、胺(L14)、膦(L15)和吡啶(L16)都是无效的,表明匹配半不稳定配体上两个螯合基团的重要性。带有两个甲氧基的三齿配体L17将2a的产率降低至13%,而L18没有得到任何所需的产物,这表明使用强配位基团代替OMe抑制了反应。然后,作者又评估了膦的芳基:1)邻位取代基(L19)的位阻和缺电子芳烃(L20,L21)均降低了收率;2)引入给电子基(L22)使产率稍微提高到45%,但是进一步增加芳烃(L23)的电子密度产率仅为35%。以L22为配体,进一步优化溶剂、温度等条件,可使收率提高至95%。图4. 芳基氟化物底物扩展(图片来源:J. Am. Chem. Soc.)在最佳反应条件下,作者通过引入吗啉基元对芳烃底物进行了考察(图4)。富电子的(2b,2c)和缺电子的(2d,2e)邻位取代的芳基氟化物都是兼容的,收率52-62%。值得注意的是,在Hartwig-Buchwald和Ullmann胺化中C-Cl键(2e)比C-F键更具活性,而在本条件下C-Cl键却仍然幸存。间位上的取代基范围很广,包括强给电子基如-OMe(2f)、-SMe(2g)、-NH2(2h)和烯烃(2i)以及电中性甲基(2j)和苄基(2k)均可耐受,以优良的收率得到所需产物。游离羟基不抑制反应(2l,2m),而伯醇在该条件下转化为胺2m。带有各种官能团(2n-2u)的对位取代的芳基氟化物也显示出良好的反应活性,且可以兼容一系列活性基团如:胺(2o)、酰胺(2r)、磺酰胺(2s)、硼酸酯(2t)和NHBoc(2u)。多取代的芳基氟化物也能以高收率(2v-2y)得到所需产物。值得注意的是,在二氟苯胺(2w)和二氟苯酚(2x)的胺化反应中观察到专一的区域选择性。对于具有两个芳族氟化物基元的底物1z,亲核取代主要发生在更富电子的芳烃上(2z),这与经典SNAr反应(2z')具有完全相反的选择性。接着,作者通过使用3,4-二氟苯胺作为限制性试剂来考察胺的范围(图5)。哌啶(3a)及其类似物(3b-3e),包括四氢异喹啉和N-甲基哌嗪,都是合适的亲核试剂,收率高达98%。四元胺氮杂环丁烷在该条件下不稳定,仅观察到痕量产物。相比之下,五元和七元胺分别以良好的收率(3g,3h)得到所需的产物。除环胺外,直链仲胺和伯胺均兼容,可以中等收率得到产物(3i-3l)。值得注意的是,在上述每种情况下均观察到优良的间位选择性。 图5. 胺底物扩展(图片来源:J. Am. Chem. Soc.)为了探究反应机理,作者合成了Ru-氟化芳烃η6-配合物4,以深入了解反应过程(图6a)。可能的SNAr胺化前体5,双膦-Ru芳烃η6-配合物,是由配合物4合成的,并通过核磁表征。根据1H和31P NMR谱,作者提出中间体5上的两个半不稳定配体是非对称的:一个同时被膦和氧螯合Ru,而另一个则被单配位。出乎意料的是,加入吗啉后氟峰立即消失,这表明胺化反应即使在室温下也能快速进行。最后,加热反应混合物,以起始配合物4为基准,以65%的产率释放出游离苯胺产物。在上述研究中,通过19F NMR未检测到游离氟芳烃的信号。实验支持胺化反应在Ru催化剂和氟代芳烃的η6-配合物上进行。此外,作者将具有非配位线性基团的二苯基丁基膦L5与芳烃解离中的半不稳定配体L6(图6b)进行了比较。在加热条件下,半不稳定配体配位的Ru配合物8在半小时内完全释放出苯胺。相比之下,使用配体L5仅检测到痕量的游离苯胺,这表明弱配位基团促进了产物芳烃从Ru中心的解离。 图6. 机理研究(图片来源:J. Am. Chem. Soc.)总结:西湖大学石航课题组开发了一种Ru(II)-半不稳定双齿配体催化的芳基氟化物的SNAr胺化反应。反应适用于富电子和电中性芳烃,且不需要过量的芳烃。反应条件温和,底物适用性广泛,可用于生物活性化合物的合成和功能化。初步的机理研究表明,取代是通过η6-配位进行的,并且半不稳定配体上的弱配位基团促进了芳烃交换步骤。康麒凯博士是该工作的第一完成人。
撰稿人:诗路化语
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn