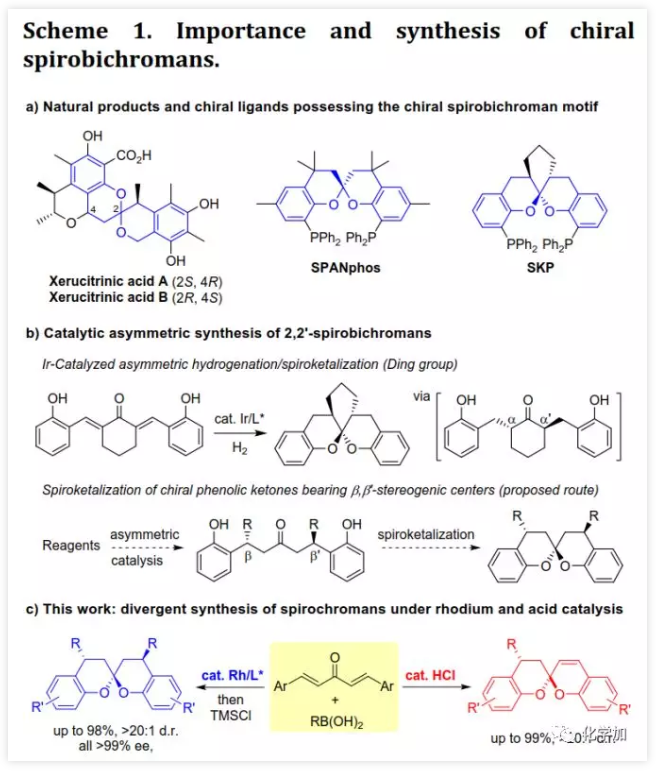
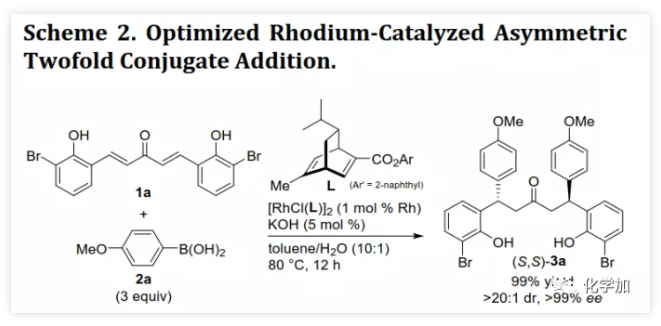
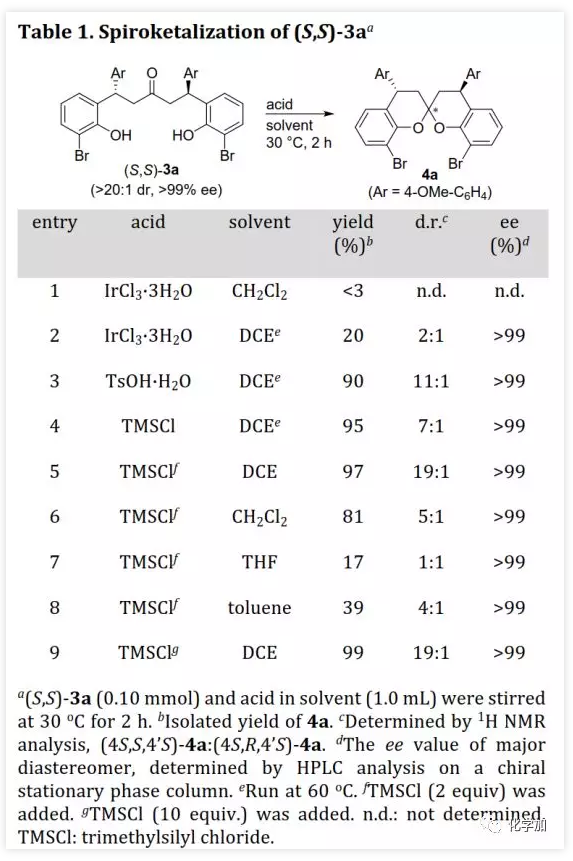
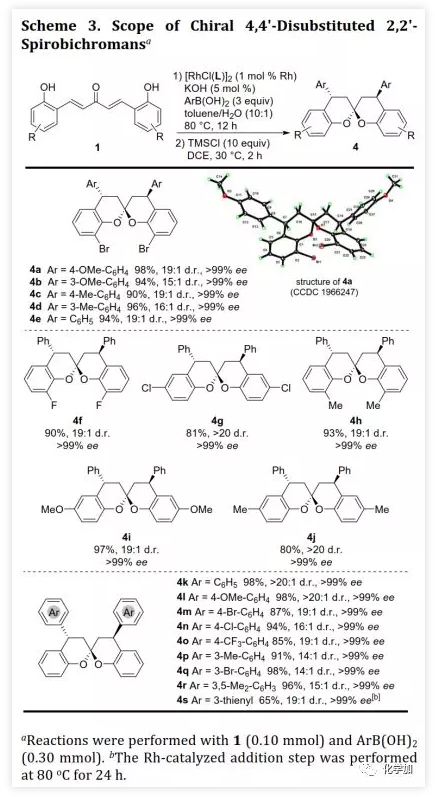
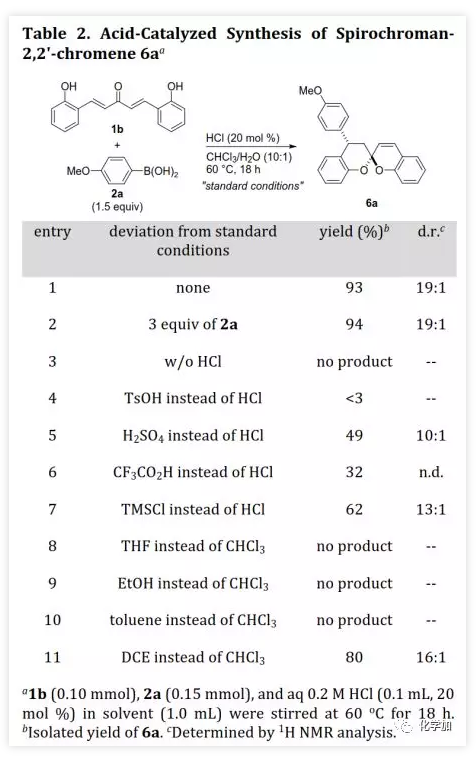
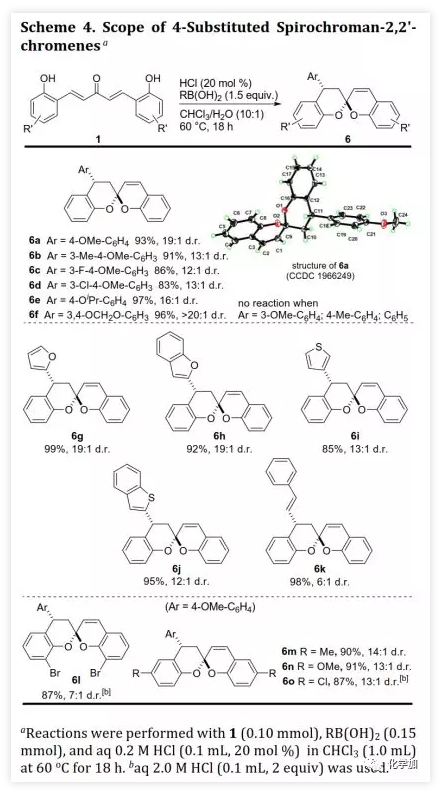
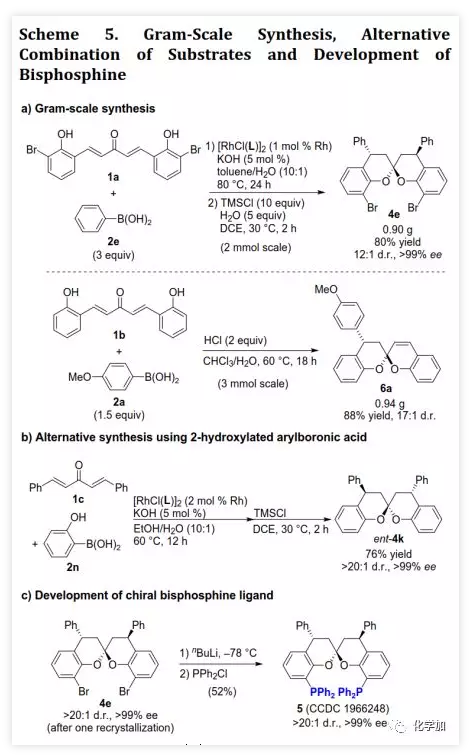
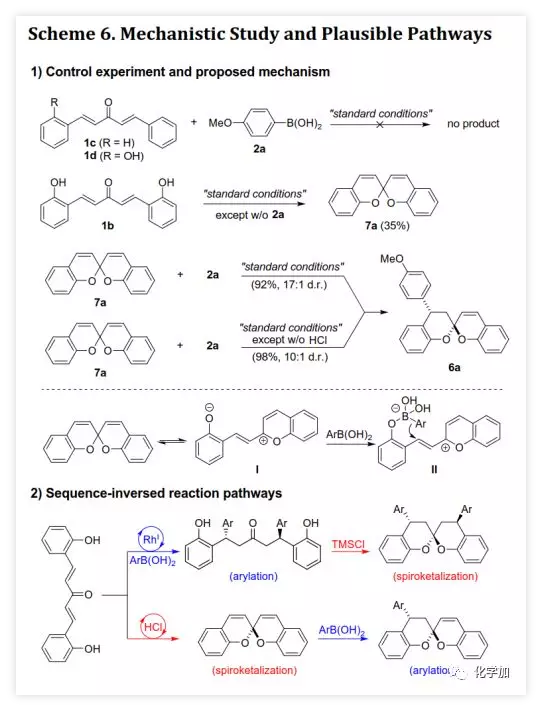
螺缩酮是天然产物、药物和功能分子中重要的结构片段。目前,化学家们已经开发了诸如分子内螺缩酮化和多组分串联反应等方法构建多种螺缩酮,但仍缺乏用于制备双苯环并[6,6]-螺缩酮(或螺双色满即螺双苯并二氢吡喃)的方法,而后者是许多生物活性天然产物的母核(如xerucitrinic acid A和B)。此外,已经开发了多种基于螺双色满结构的手性配体(Scheme 1a)用于较难的不对称转化。鉴于螺双色满的重要性,需要开发其新的合成方法,特别是不对称合成和多样性合成。丁奎岭课题组报道了手性芳香螺缩酮化合物的催化不对称合成,并通过铱催化的不对称加氢/螺缩酮化反应合成了一系列手性3,3'-环烷烃稠合2,2'-螺双色满。此后,芳香螺缩酮的不对称合成取得了很大进展,但螺双色满的不对称合成滞后。在其研究中,含α,α'-手性中心的手性酚酮被认为是关键中间体,易在IrIII催化剂存在下发生螺环化。受此启发,中国药科大学窦晓巍课题组设想是否可以利用含β,β'-手性中心的手性酚酮进行螺双色满的不对称合成(Scheme 1b)。近日,该课题组开发了一种由催化剂控制的二亚芳基丙酮和有机硼酸多样性合成螺色满的方法,用于合成手性4,4'-二取代的2,2'-螺双色满和4-取代的螺色满-2,2'-色烯(Scheme 1c),该成果发表于ACS Catal.(DOI: 10.1021/acscatal.9b05577)。首先,作者需要解决手性酚酮的催化不对称合成。最近,作者开发了一种通过铑催化的共轭加成进行的手性酚的不对称合成方法,并且还实现了铑催化的双重不对称共轭加成。因此,作者考虑在铑催化下合成手性酚酮。在最佳条件下,当用手性二烯L配位的铑催化剂(1 mol% Rh,toluene/H2O,80 ℃)时,二(2-羟基亚芳基)丙酮1a与芳基硼酸2a反应得到手性酚酮(S,S)-3a(99%,d.r.>20:1,ee >99%,Scheme 2)。随后,作者利用(S,S)-3a的螺缩酮化考察了反应条件(Table 1)。在高温下,IrIII催化剂可以促进螺缩酮化,但非对映异构体控制效果较差。此外,廉价的有机酸(如对甲苯磺酸和TMSCl)也可以促进螺缩酮化,并且过量的TMSCl有利于更好的产率和非对映体控制,其中1,2-二氯乙烷(DCE)为最佳溶剂。最后,在DCE作为溶剂以及TMSCl催化下,以99%的收率得到螺环4a(d.r.=19:1,ee >99%)。在确定了铑催化的不对称共轭加成和螺缩酮化的最佳反应条件后,作者对该方法的适用性进行了研究(Scheme 3)。通过改变芳基硼酸,可以得到一系列溴化螺双色满;含不同取代基的二(2-羟基亚芳基)丙酮也是合适的底物。芳基硼酸具有广泛的适用范围,例如含给电子、吸电子和卤素取代基的芳基硼酸以及杂芳基硼酸。此外,螺缩酮4a的结构和绝对构型通过单晶X-射线衍射确证。为了实现“一锅”法合成,作者尝试在酸存在下进行铑催化的加成反应。已知铑催化的加成反应与酸性条件不相容,所以并未得到目标产物,但意外得到螺色满-2,2'-色烯产物。在盐酸存在下,二亚芳基丙酮1b和芳基硼酸2a反应以高收率和优异的非对映选择性得到4-芳基螺色满-2,2'-色烯6a(Table 2)。当用过量的芳基硼酸进行反应时,仅产生单芳基化产物。通过进一步研究发现,酸催化剂对反应必不可少,其中HCl最佳。此外,溶剂的选择对反应也很重要,并且氯化溶剂效果更好。接下来,作者探讨了螺色满-2,2'-色烯合成的范围(Scheme 4)。含取代基的苯基硼酸、富电子的杂芳基硼酸和烯基硼酸均是合适的底物;二亚芳基丙酮底物上可以含有不同取代基。此外,产物6a的结构和相对构型通过单晶X-射线衍射确证。此外,作者利用螺缩酮4e和6a的克级规模合成证明了该方法的实用性(Scheme 5a)。除了用二(2-羟基亚芳基)丙酮作为底物之外,简单的二亚芳基丙酮和2-羟基取代芳基硼酸的组合也可以参与反应(Scheme 5b),除了开发对映体配体L或使用其他手性二烯配体之外,该组合提供了一种制备对映体螺缩酮的替代方法。螺缩酮4e可以转化为双膦化合物5(Scheme 5c),其结构和绝对构型通过单晶X-射线衍射确证,并发现其结构与SPANphos和SKP类似,或许可以用于不对称催化中。最后,作者通过对照实验进一步研究了酸催化的螺色满化合物的合成机理(Scheme 6-1)。实验发现,1b的二(2-羟基)取代对反应至关重要,将其中一个或两个去除后,未发生反应。进一步研究发现:在标准条件下,1b发生螺缩酮化得到螺双色烯7a后,会进一步与2a发生芳基化。前面实验发现酸对该反应必不可少,但对照实验表明酸对芳基化步骤并非必需的。综上所述,这些发现为酸催化的螺双色烯的形成/后续无催化剂下共轭芳基化的反应机理提供了依据。螺双色烯7a发生芳基化的可能机理为:螺双色烯7a经异裂开环形成I,其与芳基硼酸形成硼酸酯中间体II,再经分子内芳基迁移、水解和环化形成芳基化产物6a。由于缺乏形成I-型中间体的驱动力,6a无法进行二次芳基化。另一方面,铑催化剂可以有效催化二亚芳基丙酮的双重不对称共轭芳基化得到含β,β'-手性中心的手性酚酮,后者在TMSCl存在下进行分子内螺缩酮化得到螺双色满(Scheme 6-2)。
总结:中国药科大窦晓巍课题组开发了一种新的催化剂控制的螺色满(即螺苯并二氢吡喃)的合成方法,利用易得的二亚芳基丙酮和有机硼酸分别在铑催化和酸催化下实现了手性2,2'-螺双色满和螺色满-2,2'-色烯的化学多样性合成,从而为这两类重要化学结构提供了一种通用的合成方法。
撰稿人:爽爽的朝阳