

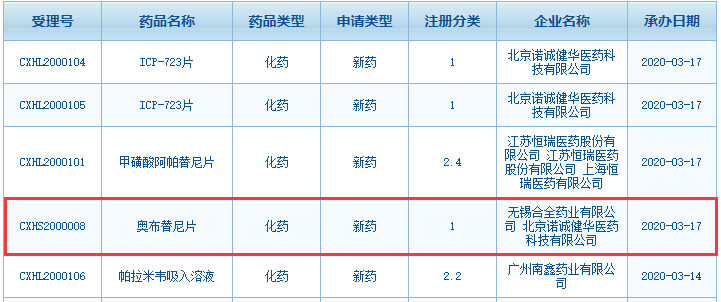
国家药监局受理诺诚健华奥布替尼用于治疗复发/难治性套细胞淋巴瘤患者的新适应症上市申请
2020年3月6日,诺诚健华宣布,中国国家药品监督管理局 (NMPA) 已受理奥布替尼 (ICP-022) 用于治疗复发/难治性套细胞淋巴瘤(MCL) 患者的新适应症上市申请(NDA)。奥布替尼由诺诚健华团队自主研发,用于治疗多种B细胞恶性肿瘤及自身免疫性疾病,目前正在中国及美国开展广泛的临床研究。诺诚健华联合创始人、董事长兼CEO崔霁松博士表示:“这是奥布替尼第二项被国家药监局受理的新药上市申请,是继今年1月奥布替尼首项NDA被纳入优先审评后,在短时间内取得的又一重要里程碑。奥布替尼的国际多中心临床数据日趋丰富,公司的商业化团队也在快速建设中,我对奥布替尼帮助全球有临床需求患者的前景有充分信心。”
这项NDA申报是基于一项评价奥布替尼 (ICP-022) 治疗复发/难治性套细胞淋巴瘤(MCL)安全性和有效性的多中心、开放性临床试验(登记号:CTR20180196)数据提交的。此前,奥布替尼用于治疗复发/难治慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者的NDA已于2019年11月获NMPA受理,并于2020年1月被纳入优先审评。
作为全球开发项目中的一部分,目前针对奥布替尼的多项临床研究正在进行中,除上述已提交NDA的适应症外,亦在中国进行复发/难治边缘区淋巴瘤(MZL)、复发/难治中枢神经系统淋巴瘤(CNSL)、复发/难治华氏巨球蛋白血症(WM)、复发/难治 CD20+B细胞淋巴瘤、复发/难治弥漫性大B细胞淋巴瘤(DLBCL)以及轻中度系统性红斑狼疮(SLE)患者的临床研究;在美国,奥布替尼针对B细胞恶性肿瘤的I期临床试验已于2019年5月获批启动。
奥布替尼 (ICP-022)

奥布替尼是一种口服BTK抑制剂,与BTK不可逆结合,诱导下游激酶失活和细胞死亡。奥布替尼的骨架中心为一单环,而非稠环。我们相信奥布替尼的高选择性源自于这一独特的结构,这将导致更少的可能导致治疗中止的非靶向副作用。
酪氨酸激酶(BTK)的作用
BTK是一种非受体酪氨酸激酶,在B细胞抗原受体(BCR)的信号传递中起着关键作用。BCR信号通路对淋巴瘤中白血病细胞的增殖和存活至关重要。BTK抑制剂选择性地阻断BTK激酶活性、通过调节信号通路干预B细胞发育,从而控制各种B细胞恶性肿瘤的致癌进展。
BTK不止在BCR信号通路,也在巨噬细胞Fc受体信号通路中方发挥作用,而B细胞和巨噬细胞是导致自身免疫疾病发病机制的两个主要细胞类型,因此BTK抑制剂有望被开发成治疗自身免疫性疾病(如类风湿性关节炎和系统性红斑狼疮)的一类新药。
奥布替尼的临床进展

奥布替尼的联合疗法
目前已经在中国开展了Orelabrutinib与新一代CD20抗体MIL62联合的临床I期,用于治疗FL患者,并计划探索与BCL-2和PI3K抑制剂等药物联合治疗其他B细胞恶性肿瘤。
临床研究数据
2019年12月9日,诺诚健华在第61届美国血液学协会(ASH)年会上,以口头报告的形式公布了由北京大学肿瘤医院朱军教授牵头的奥布替尼用于治疗复发/难治性(R/R)套细胞淋巴瘤(MCL)患者的临床研究数据,以海报展示的形式公布了由江苏省人民医院李建勇教授牵头的奥布替尼用于治疗复发/难治性(R/R)慢性淋巴细胞白血病/小细胞淋巴瘤(CLL/SLL)的临床研究数据。
奥布替尼用于治疗R/R MCL患者的有效性与安全性数据的首次报告
这项单臂、开放性、多中心的奥布替尼(ICP-022)治疗R/R MCL患者的II期临床研究试验(clinicaltrials.gov 登记号:NCT03494179),主要终点为独立评审委员会(IRC)评估的总体反应率(ORR),次要终点包括安全性及PFS、DOR等有效性指标。本研究共入组106例患者,中位随访时间10.5个月。研究结果显示:
由IRC基于CT评估的总体ORR为85.9%,其中完全缓解率(CR)为27.3%,部分缓解率(PR)为58.6%,中位DOR和PFS尚未达到。
常见不良事件(AE)多为一级或二级,主要包括血小板减少和中性粒细胞减少、贫血、呼吸系统感染以及皮疹,未观察到与治疗相关的3级GI或心脏毒性。
奥布替尼用于治疗R/R CLL/SLL患者的有效性与安全性数据的首次报告
这项单臂、开放性、多中心的奥布替尼(ICP-022)作为单药治疗R/R CLL/SLL患者的II期临床研究试验 (clinicaltrials.gov 登记号:NCT03493217) ,主要终点为独立评审委员会(IRC)评估的客观治疗反应率(ORR),次要终点包括安全性及PFS、DOR等有效性指标。本研究共入组80例患者,中位随访时间8.7个月。研究结果显示:
由IRC基于CT评估的总体ORR为88.8%,其中完全缓解率(CR/CRi)为3.8%,部分缓解率(PR/PR-L)为85.0%,中位DOR和PFS尚未达到。亚组分析显示17p缺失的ORR为100%。
常见不良事件(AE)多为一级或二级,主要包括血小板减少和中性粒细胞减少、呼吸系统感染等,未观察到房颤或继发性恶性肿瘤。
关于诺诚健华
诺诚健华由世界著名结构生物学家施一公教授和生物医药行业卓越的企业管理者崔霁松博士联合创立。专注于肿瘤及自身免疫类疾病治疗领域的一类新药研制,适用于中国病人高发的淋巴瘤、肝癌、胃癌等多种实体瘤及自身免疫类疾病。公司已有3项候选新药在中国/美国开展多中心、多适应症的临床试验。诺诚健华在北京和南京设有研发中心,在上海设有项目管理中心,在广州正在建设药品生产基地,在美国新泽西和波士顿设有分支机构开展商务合作与临床试验管理。
3月11日,诺诚健华在港交所开始公开招股,拟发行2.5亿股,其中香港发售股份数目2503.4万股,国际发售股份数目2.25亿股。另有约15%的超额配股权。发售价格区间为8.18~8.95港元/股。股份将以每手1000股股份进行买卖,入场费9040.19元。预期将于2020年3月23日正式登陆港交所。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn