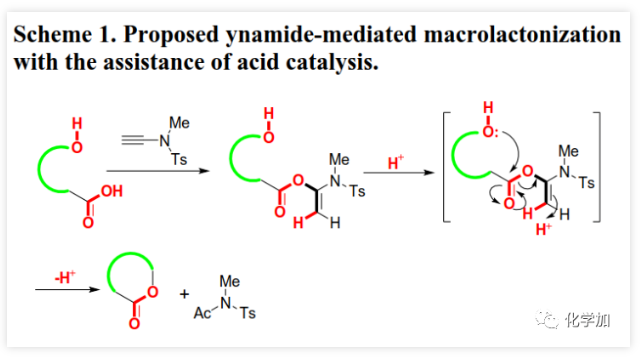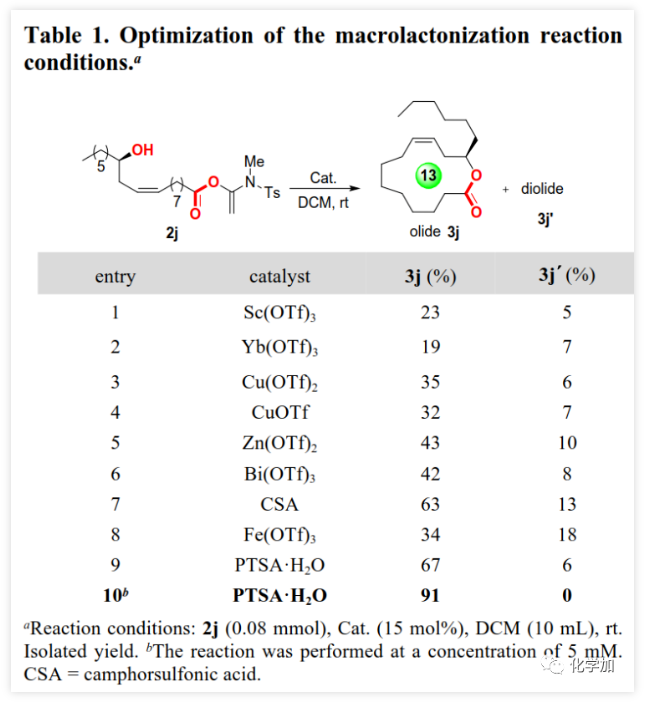
大环内酯是多种抗生素、抗癌药物、农用化学品和活性天然产物的重要结构片段(Figure 1)。目前,化学家已经开发了大量内酯化策略包括过渡金属催化的C-O键生成、通过炔烃/烯烃关环复分解或烯烃偶联构建C-C键以及N-杂环卡宾(NHC)催化醛的氧化酯化等。但这些方法的关环前体不易得、转化条件苛刻、且多涉及到过渡金属催化剂的使用,大大限制了这些方法的推广。通过开环羟基酸的分子内酯化反应实现关环一直是有机化学家重点关注的方法,但由于这一过程的熵效应和焓效应对反应都是不利的,大环内酯化反应一直是有机合成化学中一个极具挑战性的难题。目前的大环内酯化主要是通过活化开环羟基酸的羧基或羟基或二者同时活化来实现分子内酯化关环。在所有大环内酯化方法中,Yamaguchi大环内酯化反应最为常用,但其同样存在诸多的问题:对水敏感、碱诱导的含α-手性中心开环羟基酸的外消旋化、α,β-不饱和开环羟基酸的Z/E异构化以及高反应温度等经常使其在用于复杂底物分子时遭遇难以预测的困难。此外,竞争性分子间酯化的副反应也是该领域普遍存在的一个问题,目前该问题主要通过高度稀释的反应物浓度来解决(小于1 mM)。但是,α,β-不饱和开环羟基酸的Z/E异构化以及α-手性中心外消旋化等问题悬而未决,因此大环内酯化依然别具挑战,特别是对于含α,β-不饱和羧酸和α-手性中心的开环羟基酸底物。鉴于大环内酯类化合物的重要性及其所面临的问题,温和、高效的大环内酯化策略一直是有机合成化学家所迫切需要的。近期,江西师范大学赵军锋课题组在非常温和的反应条件下首次实现了炔酰胺介导的大环内酯化,该成果发表于ACS Catal.(DOI: 10.1021/acscatal.0c00523)。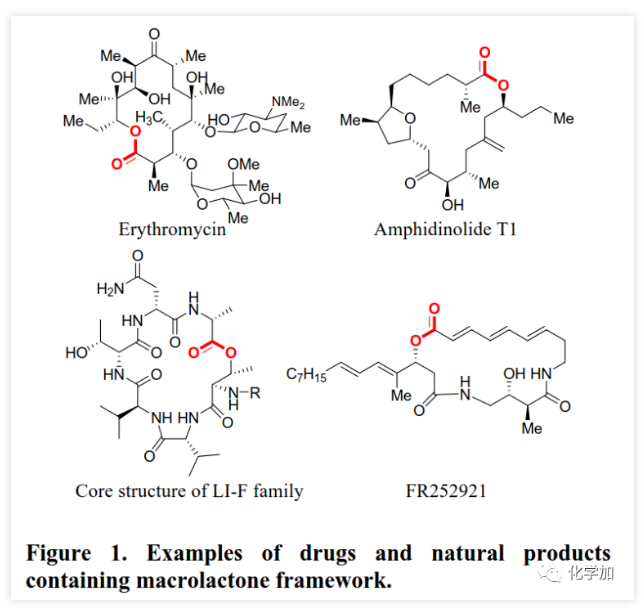 最近,作者首次报道了炔酰胺可以作为缩合剂来促成酰胺键的形成,由于炔酰胺类缩合剂可以抑制α-手性羧酸在活化过程中的外消旋化,他们成功地将炔酰胺类缩合剂用于多肽合成(J. Am. Chem. Soc., 2016, 138, 13135-13138)和硫代多肽(Angew. Chem. Int. Ed., 2019, 58, 1382-1386)的合成。值得注意的是,在多肽合成过程中,无需对Tyr、Ser或Thr等氨基酸的侧链羟基进行保护,也就是说肽键形成的条件下不会发生羟基的酯化反应。这是由于羟基较弱的亲核性造成的,也意味着酯键的形成比酰胺键形成更具挑战性。有趣的是他们在对氨解步骤进行优化时发现,当用弱酸性三氟乙醇作为溶剂时会得到少量酯化副产物。同时,计算研究表明,酸催化剂可以加速炔酰胺介导的酰胺键形成(Org. Biomol. Chem. 2017, 15, 6367-6374.)。酸催化剂可能是通过质子化端烯来降低乙烯基酯在酰基交换过程的能垒来促进反应的。因此,作者推测在酸性催化剂的辅助下,炔酰胺将有望作为大环内酯化的潜在缩合剂(Scheme 1)。在初步的研究中,作者以炔酰胺MYTsA与开环羟基酸的加成产物α-酰氧基烯胺2j作为模型底物考察了各种酸催化剂的作用(Table 1),发现Lewis和Brønsted酸均可以有效催化大环内酯化反应且后者效果更好,其中对甲苯磺酸一水合物(PTSA·H2O)为最佳催化剂。与传统对水敏感的大环内酯化反应不同,该转化可以在少量水存在下进行。虽然以较大α-酰氧基烯酰胺2j浓度(8 mM)进行大环内酯化反应时,他们观察到有少量二聚副产物(diolide)3j′产生;但当底物浓度降低至5 mM时,diolide副产物的形成可以被完全抑制。确定了最佳反应条件后,作者考察了炔酰胺介导的大环内酯化的底物范围(Scheme 2)。首先,作者利用羧酸与炔酰胺MYTsA加成制备得到多种开环羟基酸的α-酰氧基烯胺衍生物(活化酯),这些活化酯中间体都比较稳定,可以进行常规的柱层析纯化、结构表征和储存。含长脂肪链的开环羟基酸的酸性较低,导致其与炔酰胺加成反应变慢,但作者发现15% mol 的CuCl催化剂可以加速这步反应。研究表明这些开环羟基酸的α-酰氧基烯胺衍生物都可以在PTSA·H2O催化作用下顺利进行大环内酯化反应,均可以良好或优异的收率得到预期的大环内酯化产物(Scheme 2)。与常规的大环内酯化反应需要在极低的底物浓度下反应(≤1 mM)不同,本文作者开发的炔酰胺介导的大环内酯化可以在5~100 mM底物浓度下进行反应且不会形成diolide副产物。在其他大环内酯化策略中难以制备的8~13元环的中等大环内酯也可以通过该方法构建。可喜的是,α,β-不饱和开环羟基酸对该反应具有很好的耐受性,可以优异的收率得到目标大环内酯,并且C2-C3位双键不会发生Z/E异构化。此外,该方法还适用于制备含酯基和酰胺的大环内酯肽。在炔酰胺介导的大环内酯化过程中,手性α-氨基酸残基的光学纯度得到了很好的保持。该方法通过大环内酯化反应而非内酰胺化反应作为最终的关环步骤,为合成大环内酯肽提供了一种高效的替代方法。为了系统深入地研究影响炔酰胺介导的大环内酯化反应效率的因素,文中的大多数大环内酯化反应是以两步方式进行的。但由于第一步反应的效率非常高,一般都是以定量的收率得到活化酯中间体,且无需纯化即可进行下一步反应。所以,这些反应均可以通过“一锅两步”法进行,从而简化了操作步骤。
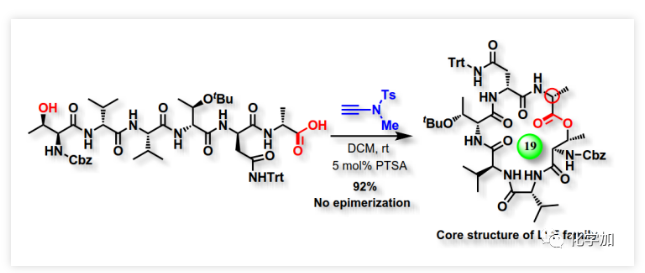
最近,作者首次报道了炔酰胺可以作为缩合剂来促成酰胺键的形成,由于炔酰胺类缩合剂可以抑制α-手性羧酸在活化过程中的外消旋化,他们成功地将炔酰胺类缩合剂用于多肽合成(J. Am. Chem. Soc., 2016, 138, 13135-13138)和硫代多肽(Angew. Chem. Int. Ed., 2019, 58, 1382-1386)的合成。值得注意的是,在多肽合成过程中,无需对Tyr、Ser或Thr等氨基酸的侧链羟基进行保护,也就是说肽键形成的条件下不会发生羟基的酯化反应。这是由于羟基较弱的亲核性造成的,也意味着酯键的形成比酰胺键形成更具挑战性。有趣的是他们在对氨解步骤进行优化时发现,当用弱酸性三氟乙醇作为溶剂时会得到少量酯化副产物。同时,计算研究表明,酸催化剂可以加速炔酰胺介导的酰胺键形成(Org. Biomol. Chem. 2017, 15, 6367-6374.)。酸催化剂可能是通过质子化端烯来降低乙烯基酯在酰基交换过程的能垒来促进反应的。因此,作者推测在酸性催化剂的辅助下,炔酰胺将有望作为大环内酯化的潜在缩合剂(Scheme 1)。在初步的研究中,作者以炔酰胺MYTsA与开环羟基酸的加成产物α-酰氧基烯胺2j作为模型底物考察了各种酸催化剂的作用(Table 1),发现Lewis和Brønsted酸均可以有效催化大环内酯化反应且后者效果更好,其中对甲苯磺酸一水合物(PTSA·H2O)为最佳催化剂。与传统对水敏感的大环内酯化反应不同,该转化可以在少量水存在下进行。虽然以较大α-酰氧基烯酰胺2j浓度(8 mM)进行大环内酯化反应时,他们观察到有少量二聚副产物(diolide)3j′产生;但当底物浓度降低至5 mM时,diolide副产物的形成可以被完全抑制。确定了最佳反应条件后,作者考察了炔酰胺介导的大环内酯化的底物范围(Scheme 2)。首先,作者利用羧酸与炔酰胺MYTsA加成制备得到多种开环羟基酸的α-酰氧基烯胺衍生物(活化酯),这些活化酯中间体都比较稳定,可以进行常规的柱层析纯化、结构表征和储存。含长脂肪链的开环羟基酸的酸性较低,导致其与炔酰胺加成反应变慢,但作者发现15% mol 的CuCl催化剂可以加速这步反应。研究表明这些开环羟基酸的α-酰氧基烯胺衍生物都可以在PTSA·H2O催化作用下顺利进行大环内酯化反应,均可以良好或优异的收率得到预期的大环内酯化产物(Scheme 2)。与常规的大环内酯化反应需要在极低的底物浓度下反应(≤1 mM)不同,本文作者开发的炔酰胺介导的大环内酯化可以在5~100 mM底物浓度下进行反应且不会形成diolide副产物。在其他大环内酯化策略中难以制备的8~13元环的中等大环内酯也可以通过该方法构建。可喜的是,α,β-不饱和开环羟基酸对该反应具有很好的耐受性,可以优异的收率得到目标大环内酯,并且C2-C3位双键不会发生Z/E异构化。此外,该方法还适用于制备含酯基和酰胺的大环内酯肽。在炔酰胺介导的大环内酯化过程中,手性α-氨基酸残基的光学纯度得到了很好的保持。该方法通过大环内酯化反应而非内酰胺化反应作为最终的关环步骤,为合成大环内酯肽提供了一种高效的替代方法。为了系统深入地研究影响炔酰胺介导的大环内酯化反应效率的因素,文中的大多数大环内酯化反应是以两步方式进行的。但由于第一步反应的效率非常高,一般都是以定量的收率得到活化酯中间体,且无需纯化即可进行下一步反应。所以,这些反应均可以通过“一锅两步”法进行,从而简化了操作步骤。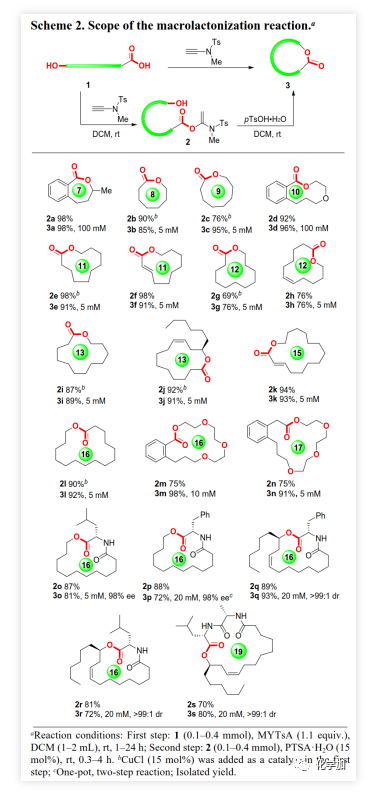 为了进一步展示该策略在复杂大环内酯类天然产物全合成中的应用潜力,作者利用炔酰胺介导的大环内酯化反应作为关键步骤实现了大环内酯肽类天然产物脱羟基LI-F04a的全合成。由芽孢杆菌属(Paenibacillus)产生的大环内酯肽类LI-F家族表现出显著的抗真菌活性,其环六肽母核理论上可以通过任一酰胺键或酯键的形成来关环。但是,不少线性多肽片段在进行分子间酯化时充满了挑战,而且有些酯键在后续的操作中会受到其它亲核试剂的进攻而断开。因此,通过酯键的形成来关环的大环内酯化反应成为构建大环内酯肽类化合物环骨架的有力策略。大环内酯肽类天然产物LI-F04a就属于这样一类分子,澳大利亚悉尼大学的Jolliffe课题组曾经对LI-F04a进行过深入系统的研究,她们发现LI-F04a家族分子只能通过大环内酯化来关环,且关环位点的D-Ala残基的绝对构型对生物活性至关重要,因为这个D-Ala残基的外消旋化会直接导致其抗菌活性完全消失。然而,大多数常见的大环内酯化反应均会造成该D-Ala残基的大量差向异构化。经过系统的筛选与优化,最后她们通过改进的Yamaguchi大环内酯化以96:4的 dr值和52%的收率实现了LI-F04a的环骨架的构建(Table 2,entry 9,)。因此,作者认为该环六肽母核的大环内酯肽骨架结构是评估炔酰胺介导的大环内酯化策略在复杂体系中应用效果的理想模型。为了与其他大环内酯化策略进行对比,作者通过多肽固相合成获得了线性六肽酸I,并以其作为底物考察了一系列缩合试剂和常规的大环内酯化策略(Table 2)。与Jolliffe课题组观察到的结果类似,大多数常见大环内酯化策略不仅会发生显著的差向异构化,而且还会产生大量的diolide副产物III′,从而导致目标产物环酯肽III的收率非常低或者根本就得不到相应的关环产物。值得高兴的是,炔酰胺缩合剂介导的线性六肽酸I的大环内酯化以两步92%的总收率和大于99:1的dr值得到了目标环酯肽产物III。与其它大环内酯化方法相比,炔酰胺缩合剂MYTsA介导的大环内酯化在抑制α-手性酸外消旋化上显示出了极大的优越性。另外,当以2.5 mM的底物浓度进行大环内酯化时,未检测到diolide副产物(当浓度增加至10 mM时,观察到部分diolide的形成)。以环酯肽III为关键中间体,参考文献的方法,作者顺利实现了大环内酯肽类天然产物脱羟基LI-F04a VI的全合成(5步,40%收率)。
为了进一步展示该策略在复杂大环内酯类天然产物全合成中的应用潜力,作者利用炔酰胺介导的大环内酯化反应作为关键步骤实现了大环内酯肽类天然产物脱羟基LI-F04a的全合成。由芽孢杆菌属(Paenibacillus)产生的大环内酯肽类LI-F家族表现出显著的抗真菌活性,其环六肽母核理论上可以通过任一酰胺键或酯键的形成来关环。但是,不少线性多肽片段在进行分子间酯化时充满了挑战,而且有些酯键在后续的操作中会受到其它亲核试剂的进攻而断开。因此,通过酯键的形成来关环的大环内酯化反应成为构建大环内酯肽类化合物环骨架的有力策略。大环内酯肽类天然产物LI-F04a就属于这样一类分子,澳大利亚悉尼大学的Jolliffe课题组曾经对LI-F04a进行过深入系统的研究,她们发现LI-F04a家族分子只能通过大环内酯化来关环,且关环位点的D-Ala残基的绝对构型对生物活性至关重要,因为这个D-Ala残基的外消旋化会直接导致其抗菌活性完全消失。然而,大多数常见的大环内酯化反应均会造成该D-Ala残基的大量差向异构化。经过系统的筛选与优化,最后她们通过改进的Yamaguchi大环内酯化以96:4的 dr值和52%的收率实现了LI-F04a的环骨架的构建(Table 2,entry 9,)。因此,作者认为该环六肽母核的大环内酯肽骨架结构是评估炔酰胺介导的大环内酯化策略在复杂体系中应用效果的理想模型。为了与其他大环内酯化策略进行对比,作者通过多肽固相合成获得了线性六肽酸I,并以其作为底物考察了一系列缩合试剂和常规的大环内酯化策略(Table 2)。与Jolliffe课题组观察到的结果类似,大多数常见大环内酯化策略不仅会发生显著的差向异构化,而且还会产生大量的diolide副产物III′,从而导致目标产物环酯肽III的收率非常低或者根本就得不到相应的关环产物。值得高兴的是,炔酰胺缩合剂介导的线性六肽酸I的大环内酯化以两步92%的总收率和大于99:1的dr值得到了目标环酯肽产物III。与其它大环内酯化方法相比,炔酰胺缩合剂MYTsA介导的大环内酯化在抑制α-手性酸外消旋化上显示出了极大的优越性。另外,当以2.5 mM的底物浓度进行大环内酯化时,未检测到diolide副产物(当浓度增加至10 mM时,观察到部分diolide的形成)。以环酯肽III为关键中间体,参考文献的方法,作者顺利实现了大环内酯肽类天然产物脱羟基LI-F04a VI的全合成(5步,40%收率)。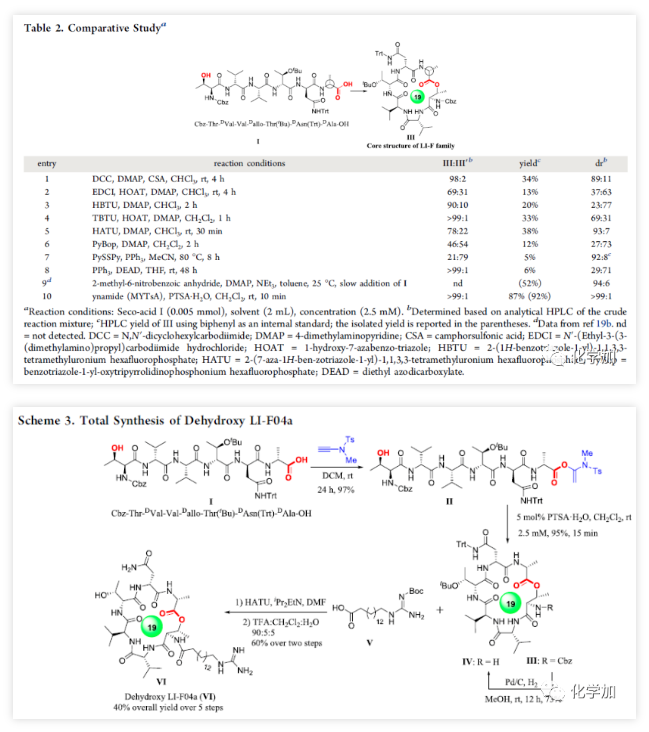 总结:江西师大赵军锋课题组基于他们原创的炔酰胺类缩合试剂,开发了一种炔酰胺介导的大环内酯化策略。炔酰胺通过与开环羟基酸的羧基加成得到α-酰氧基烯胺(活化酯)来实现对羧基的活化,然后在酸催化剂的作用下,羟基通过分子内酯交换最终实现大环内酯化。该方法在用于含有α-手性中心的开环羟基酸和含有共轭烯烃的α,β-不饱和开环羟基酸时展现出了显著的优越性,可以完全避免其他大环内酯化中常见的α-手性中心的外消旋化和C2-C3双键的Z/E异构化。此外,该策略还可以在较高底物浓度下进行反应而不形成diolide副产物。该反应可以在室温下的空气氛围中进行,避免了传统大环内酯化反应的高温、强碱性及严格的无水条件,简化了实验操作。可以预见,作者开发的这种高效的大环内酯化方法将在大环内酯类化合物的合成中获得广泛应用,特别是那些含α-手性中心以及α,β-不饱和羧酸的开环羟基酸前体。相关研究工作近期发表在ACS Catalysis上,江西师范大学硕士研究生杨明和王雪伟为文章共同第一作者。该工作受到了人社部高层次留学人才回国资助计划、国家自然科学基金面上项目和重大研究计划培育项目的支持。原文链接:Ming Yang, Xuewei Wang, Junfeng Zhao .Ynamide-Mediated Macrolactonization.ACS Catal. 2020, DOI: org/10.1021/acscatal.0c00523赵军锋课题组介绍:https://zhao.jxnu.edu.cn/
总结:江西师大赵军锋课题组基于他们原创的炔酰胺类缩合试剂,开发了一种炔酰胺介导的大环内酯化策略。炔酰胺通过与开环羟基酸的羧基加成得到α-酰氧基烯胺(活化酯)来实现对羧基的活化,然后在酸催化剂的作用下,羟基通过分子内酯交换最终实现大环内酯化。该方法在用于含有α-手性中心的开环羟基酸和含有共轭烯烃的α,β-不饱和开环羟基酸时展现出了显著的优越性,可以完全避免其他大环内酯化中常见的α-手性中心的外消旋化和C2-C3双键的Z/E异构化。此外,该策略还可以在较高底物浓度下进行反应而不形成diolide副产物。该反应可以在室温下的空气氛围中进行,避免了传统大环内酯化反应的高温、强碱性及严格的无水条件,简化了实验操作。可以预见,作者开发的这种高效的大环内酯化方法将在大环内酯类化合物的合成中获得广泛应用,特别是那些含α-手性中心以及α,β-不饱和羧酸的开环羟基酸前体。相关研究工作近期发表在ACS Catalysis上,江西师范大学硕士研究生杨明和王雪伟为文章共同第一作者。该工作受到了人社部高层次留学人才回国资助计划、国家自然科学基金面上项目和重大研究计划培育项目的支持。原文链接:Ming Yang, Xuewei Wang, Junfeng Zhao .Ynamide-Mediated Macrolactonization.ACS Catal. 2020, DOI: org/10.1021/acscatal.0c00523赵军锋课题组介绍:https://zhao.jxnu.edu.cn/
撰稿人:爽爽的朝