

(图片来源:Angew. Chem. Int. Ed.)
重排反应,作为有机化学领域中最具吸引力的方法之一,具有操作简便、高原子经济性的特点,可用于构建多种新型化合物。而在自由基参与迁移策略中, 1,2-重排作为该领域的热点。早在1944年,Urry和Kharasch等发现以β-芳基碳自由基的第一个自由基1,2-迁移过程(neophyl重排),然而,由于存在底物范围窄、反应缓慢、反应条件苛刻等弊端,从而使其难以在合成中得到应用。
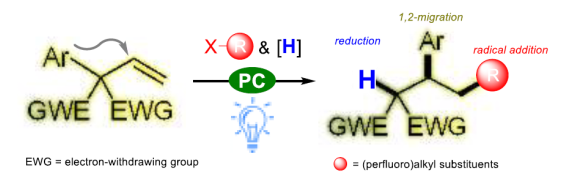
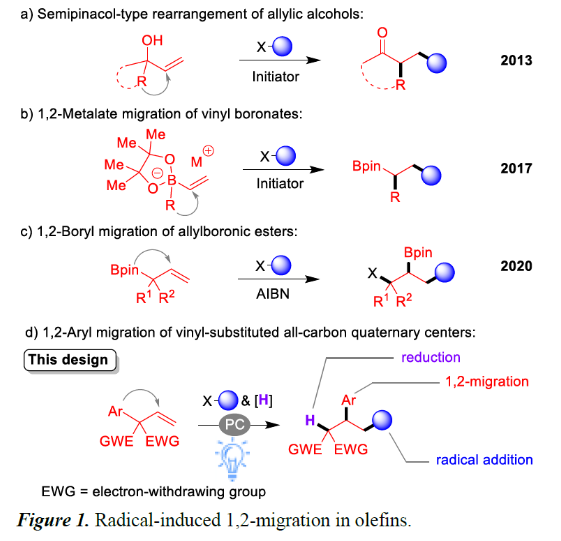
在过去的十年中,已有多个课题组通过对烯烃底物的设计,实现自由基诱导的1,2-重排。如烯丙醇的半频哪醇型重排,合成β-官能化的酮化合物(Figure 1a)。此外,也已使用Et3B /空气、可见光或镍催化剂,实现乙烯基硼酸酯配合物的1,2-金属盐重排(Figure 1b)。受上述的启发,史壮志课题组还开发了光氧化还原烯烃1,2-硼基迁移策略,通过自由基加成生成偕-双(硼基)烷烃。此外,Studer课题组近期报道了一种使用烯丙基硼酸酯的1,2-硼基迁移策略,获得1,3-二官能团化的产物(Figure 1c)。此外,在有机化合物中,引入全氟烷基取代基通常会导致其性质(如极性、溶解度、构象行为和代谢稳定性)发生很大变化,而烯烃的全氟烷基化是最有效方法之一。与以前文献不同,该反应通过全氟烷基-自由基加成至烯烃双键上,再经1,2-芳基迁移,最后,通过氢供体将其进一步还原。在此,南京大学史壮志教授课题组使用一类具有邻季碳中心的烯烃底物,涉及自由基加成、1,2-芳基迁移、还原的过程,从而实现了此类反应(Figure 1d)。
(图片来源:Angew. Chem. Int. Ed.)
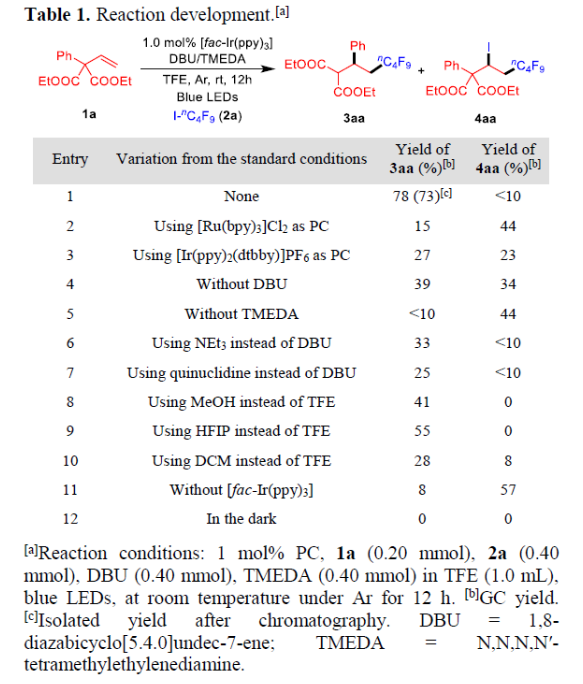
首先,作者以烯烃1a与卤化物I-nC4F9(2c)作为模型底物,进行了相关反应条件的筛选(Table 1)。当以1.0 mol%fac-[Ir(ppy)3]作为光催化剂,2当量DBU作碱,在TFE溶液中(含有2.0当量的TMDEA)室温蓝色LED照射12 h后,即可获得所需产物3aa,收率为78%(entry 1)。
(图片来源:Angew. Chem. Int. Ed.)
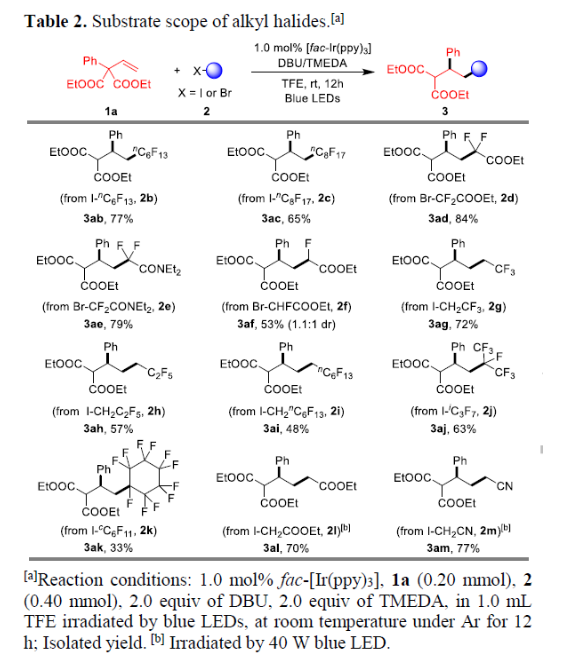
在获得上述最佳反应条件后,作者固定烯烃底物1a,对烷基卤化物2进行了扩展(Table 2)。具有较长链的全氟烷基碘与体系兼容,如nC6F13I(2b)和nC8F17I(2c)。同样,二氟甲基化的烷基溴化物2d-2e也是合适的底物,但单氟甲基化底物2f的非对映选择性较差。而具有更长全氟链烷基碘化物2g-2i,同样取得较好的结果。此外,具有三级脂肪族全氟烷基碘化物2j-2k也可同样与体系兼容。值得注意的是,其它烷基卤化物,如2-碘乙酸乙酯(2l)和2-碘乙腈(2m),同样获得所需的目标产物
(图片来源:Angew. Chem. Int. Ed.)
鉴于氟甲基在合成中的重要性,作者分别引入不同氟代试剂进行相关的扩展(Scheme 1)。使用CF3I(2n)与烯烃1a在标准条件下反应,以69%的收率获得所需的产物3an。而当使用TMEDA·2CF3I(2n')时,收率可提高至75%。同时,使用二氟试剂2o与烯烃1a进行二氟甲基化时,以56%的收率获得产物3ao。然而,使用单氟试剂2p仅有较低的反应性,可能是由于缺乏自由基稳定基团所致。
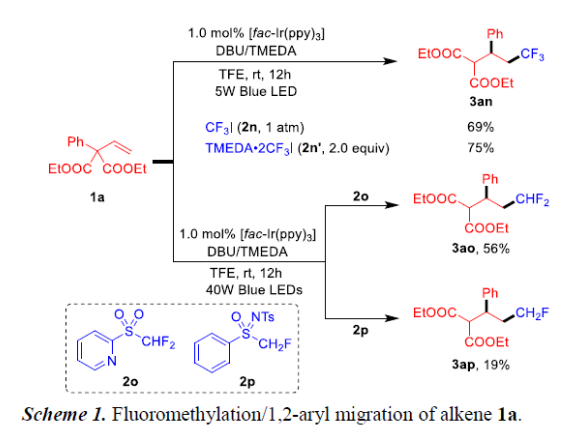
(图片来源:Angew. Chem. Int. Ed.)
紧接着,作者对烯烃底物1进行了扩展(Table 3)。芳基对位取代基不受电子效应影响(如OMe、Ph、F、Br 、CN),均可获得相应的产物3ba-3fa(54-89%)。芳基间位含有CF3、COOEt和Cl等取代基时,获得产物3ga-3ia。具有萘基、杂芳基取代时,也可获得产物3ja-3ka。同时,含有多种EWGs时,如两个COOMe的底物1l,一个氰基和一个酯基的底物1m,均可实现相应的转化。然而,具有大位阻的巴比妥酸底物1n与2a反应时,获得ATRA(原子转移自由基加成)产物4na(主产物)以及痕量的目标产物3na(<10%)。而使用上述试剂2o与烯烃1n反应时,若底物中不存在I原子,则使重排的转化率更高,获得51%收率3no。此外,仅含一个EWGs的2-乙基-2-苯基丁-3-烯酸乙酯(1o)的重排反应非常缓慢,且ATRA化合物4oa为主产物。
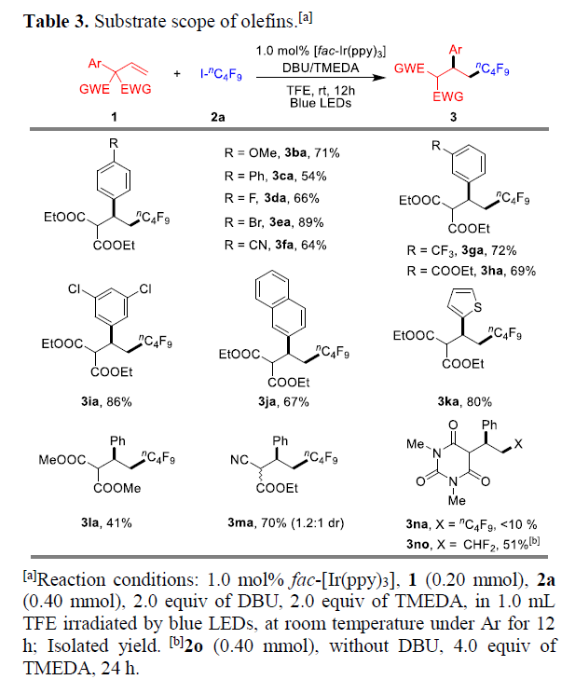
(图片来源:Angew. Chem. Int. Ed.)
随后,作者对产物3an进行了相关的修饰,从而进一步证明该反应实用性(Scheme 2)。首先,在2.0 mmol的放大实验中,以58%的收率获得产物3an。产物3an可选择性地还原成二醇5(89%)或脱羧成酯6(81%)。同时,也可以经Michael加成反应(7),亲核取代反应(8-9)和Aldol反应(10)生成具有全碳季碳中心的产物,收率为73-84%。此外,在碱性条件下,可用NBS将产物3an进行溴化,以中等收率获得化合物11。
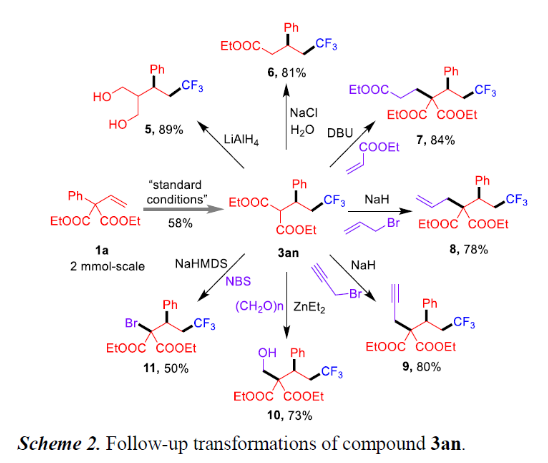
(图片来源:Angew. Chem. Int. Ed.)
为了进一步了解反应的机理,作者进行了相关的对照实验(Scheme 3)。首先,副产物4aa在标准条件下未形成产物3aa,从而排除了4aa作为中间体的可能性(Scheme 3a)。据Sodeoka课题组报道,化合物12-13与更长的烯基链反应形成环化产物14和15,未检测到1,n-芳基迁移产物(Scheme 3b)。当使用d1-MeOH作为溶剂进行烯烃1a和2a的反应时,D标记几乎完全结合到3aa中。通过13C NMR进一步检测,反应混合物在90.4和54.8 ppm处产生两个信号峰,这与该反应中d1-甲氧基甲醇(16)一致。而且,d1-MeOH与3aa不会形成氘代产物D-3aa(Scheme 3c)。这些结果表明,在反应过程中发生了H/D交换过程,并且醇溶剂充当了产物氢原子的供体。此外,“明/暗”实验进一步证实可见光是反应必需的。
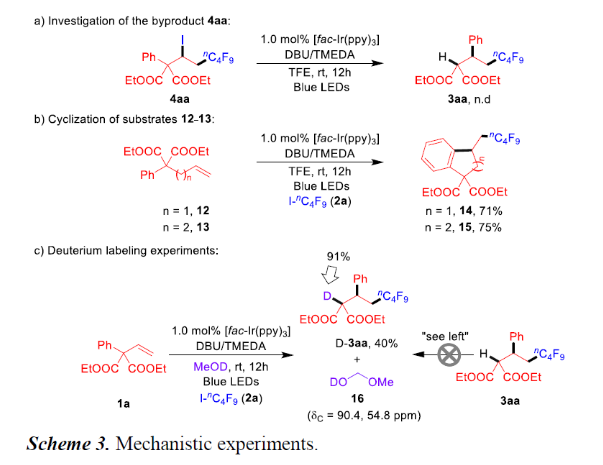
(图片来源:Angew. Chem. Int. Ed.)
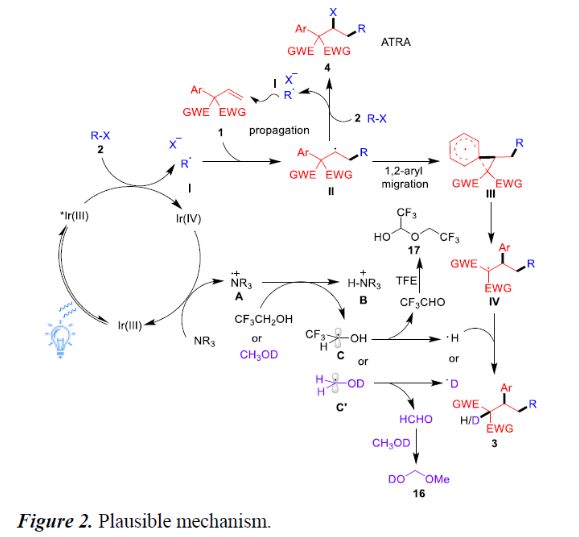
根据上述的实验,作者提出了一种可能的反应机理(Figure 2)。首先,可见光对IrIII配合物进行光激发,得到具有氧化还原活性的激发态*IrIII,它与烷基卤化物2进行单电子转移(SET)以产生IrIV配合物和烷基自由基I。紧接着,自由基I与烯烃1加成,形成烷基自由基II,经螺[2.5]-辛二烯基自由基过渡态III的1,2-芳基迁移形成自由基IV。最后,自由基IV与氢自由基结合,从而生成目标产物3。同时,烷基II也可与卤代烷2反应,形成ATRA产物4。
此外,机理还涉及一些其它的催化循环过程。IrIV配合物与叔胺进行SET反应以回收IrIII配合物并生成胺自由基阳离子A。紧接着,A与TFE溶剂进行氢原子转移,从而释放出铵盐B以及碳中心自由基C。进一步的β-H消除可形成CF3CHO和一个氢原子基团。而从反应混合物中通过NMR观察到三氟乙氧基半缩醛17的形成,假定它是由CF3CHO和TFE形成的。同样,使用d1-MeOH作为溶剂会生成氘产物D-3aa和HCHO,根据实验结果,它们可以进一步与d1-MeOH反应,生成化合物20。
(图片来源:Angew. Chem. Int. Ed.)
总结:南京大学史壮志教授课题组开发了一种高效且通用的可见光氧化还原催化策略,从而合成多种多取代全氟烷基化合物。该反应使用邻季碳中心烯烃作为底物,涉及自由基加成、1,2-芳基迁移、还原等过程,并使一个C-C键断裂同时形成一个C-H和两个C-C键。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn