

上世纪四五十年代,Wittig和Roberts等人的研究首次发现和证实了苯炔中间体。此后,苯炔反应在合成化学和生命科学中受到广泛关注,成为实验和理论化学研究的重要活性中间体。由于巨大的角张力,苯炔三键的p轨道重叠较差,导致LUMO轨道能量降低。因此苯炔表现出极高的亲电性,能够快速与亲核物种反应。作为高活性的中性中间体,苯炔的反应一般可自发进行,难以进行催化调控,实现对苯炔的立体选择性捕获极为困难,以苯炔作为活性中间体的不对称催化转化仍是挑战性难题。
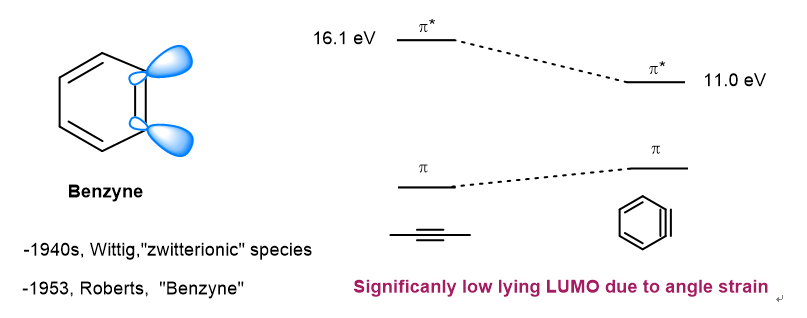
苯炔发现历史(左)和HOMO-LUMO轨道示意图(右)
近几年来,电化学合成作为一种绿色高效的合成方法得到了飞速的发展,这其中极具挑战性的不对称电催化合成领域备受关注,成为合成领域的热门研究方向。最近,清华大学罗三中教授团队研究发现,在电化学氧化条件下,氨基苯并三唑可持续稳定的生成高活性苯炔中间体,并且该过程与不对称氨基催化过程具有较好的兼容性。结合团队自己开发的伯叔二胺型手性有机小分子催化剂,可以极高的对映选择性实现β-酮羰基化合物的不对称烯胺芳基化反应。该催化过程也可适用于原位生成环己炔中间体,从而可实现羰基化合物的不对称环己烯化反应。控制实验和理论计算表明,四水合乙酸钴作为添加剂可稳定苯炔并促进苯炔与烯胺的结合。针对对映选择性过程的理论计算探索表明,形成S构型产物的过渡态(TS)中烯胺中间体苄基部分需要有更大的扭曲来减少苯炔靠近时的位阻效应,从而使得形成R构型产物更有利。此外,反应可能经历协同C-C键形成和质子化叔胺N-H转移的过程,同样使形成R构型产物更为有利。该反应对于五元、六元环状β-酮酯,五元环状β-酮酰胺都能得到比较好的结果,并且对苯基取代的1-氨基苯并三唑和环己三唑也有很好的兼容性,以高对映选择性得到芳基化和烯基化的产物。
罗三中教授团队的该项工作为首例基于苯炔的高效不对称催化报道,为构建手性α-芳基季碳化合物提供了一种简便的方法。罗三中教授的博士生李龙吉和博士后李遥博士为该论文的共同第一作者。该论文第一单位为清华大学化学系基础分子科学中心,中国科学院化学研究所为论文合作单位。该工作得到了国家自然科学基金委,清华大学自主科研计划理科专项和中组部万人计划的支持。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn