

一、药品基本情况
1、药品名称:盐酸普拉克索缓释片
剂型:片剂
注册分类:化学药品 4 类
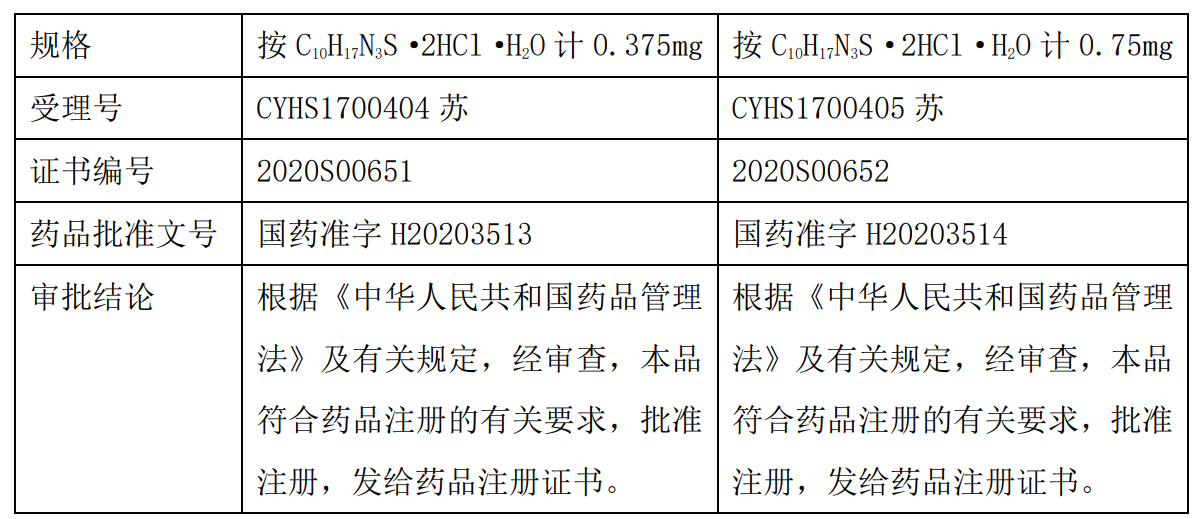
2、药品的其他相关情况
2017年10月19日,恒瑞医药向江苏省食品药品监督管理局递交的药品注册申请获得受理。盐酸普拉克索缓释片是一种多巴胺受体激动剂,通过兴奋纹状体的多巴胺受体减轻帕金森病患者的运动障碍,用于治疗成人特发性帕金森病的体征和症状。
帕金森氏综合症是一种慢性、进行性、中枢神经系统退行性疾病,其主要特征为黑质纹状体通路的退变,主要症状为运动减少、肌张力强直和震颤,病因和发病机制迄今尚未完全阐明。帕金森氏综合症一般在50~65岁开始发病,发病率随年龄增长而逐渐增加,60岁发病率约为1‰,70岁发病率达3‰~5‰,我国目前大概有170多万人患有这种疾病。
迄今为止,对帕金森氏综合症的治疗均为对症治疗,尚无根治方法可以使变性的神经细胞恢复。目前主要以药物治疗为主,治疗药物包括抗胆碱能药物、复方左旋多巴、多巴胺受体激动剂和单胺氧化酶抑制剂等。
盐酸普拉克索由德国Boehringer Ingelheim公司开发,普通片于1997年在美国首先上市,商品名为Mirapex,用于治疗帕金森病。恒瑞医药盐酸普拉克索缓释片以化学药品4类申报注册获批,视同通过仿制药一致性评价。 2010年2月,美国FDA批准了Boehringer Ingelheim公司开发的盐酸普拉克索缓释片,商品名为Mirapex ER,随后Mirapex ER在欧盟等多国陆续获批上市。2014年8月勃林格殷格翰国际贸易(上海)有限公司的盐酸普拉克索缓释片被国家食品药品监督管理总局批准进口,规格为0.375mg、0.75mg、1.5mg、3mg、4.5mg,用于治疗帕金森病。除恒瑞医药外,国内已有浙江京新同类产品获批上市;另有成都百裕、成都康弘、北京北大维信生物等在内的12家企业已提交ANDA申请,目前还未见获批信息。经查询EvaluatePharma数据库,Mirapex2019年全球销售额约为2.19亿美元。
截至目前,该产品累计已投入研发费用约为1,832万元人民币。
参考资料:
【1】恒瑞医药:http://www.hrs.com.cn/main_newshow/show-6534.html
【2】巨潮资讯:江苏恒瑞医药股份有限公司关于获得药品注册证书的公告
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn