

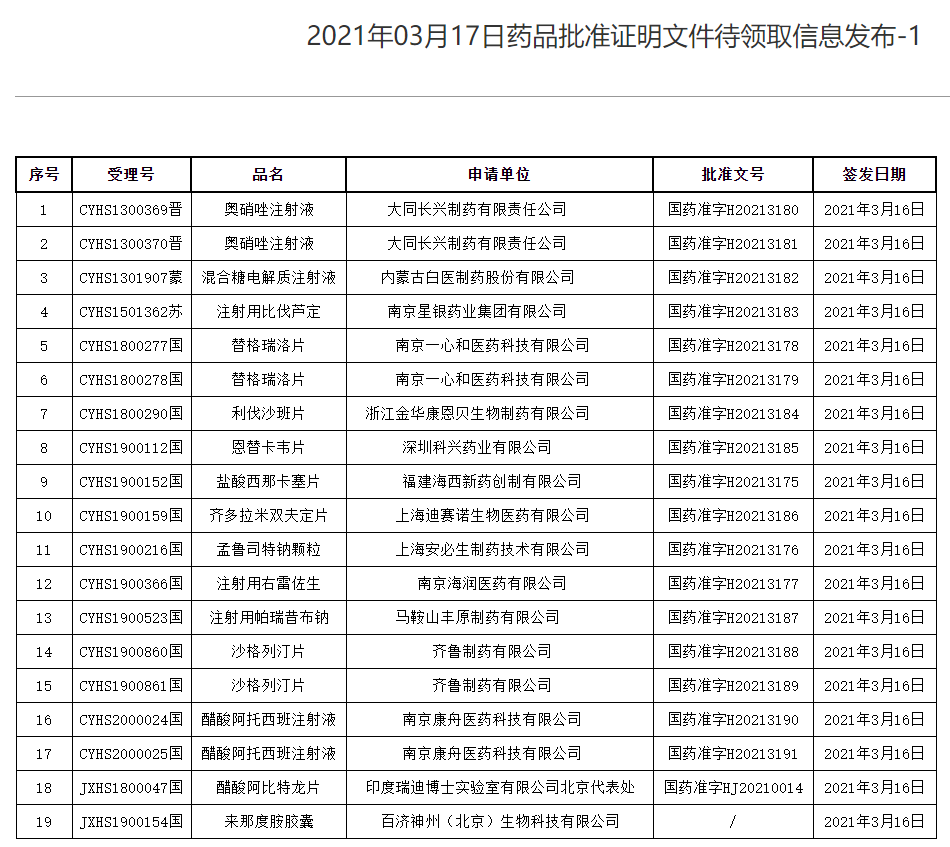
在国家药监局发布的药品批准证明文件待领取信息中,我们可以看到有受理号和批准文号两列,这两列都是“汉字+字母+数字”的组合,它们分别代表什么,如何读懂呢?下文为大家揭秘。
一、药品注册受理号
受理号是国家食品药品监督管理局对所受理药品注册申请进行审批所用的操作标记。应当统一格式,统一编排,能够直观识别,方便操作处理。受理时,对一件申请发给惟一的受理号。
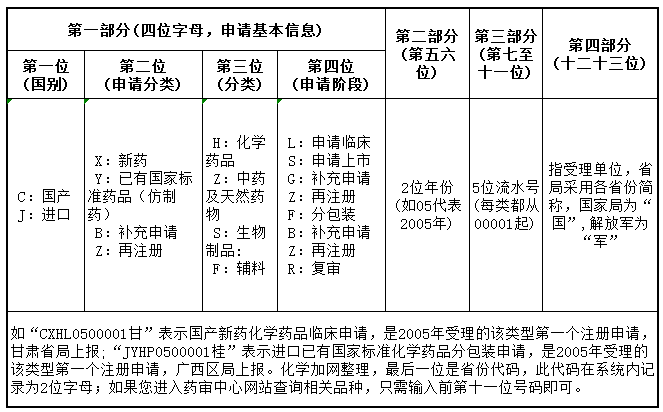
受理号分为四部分,第一部分是申请的基本信息,第二部份是年份,第三部分是流水号,第四部分是受理单位标识。一般由4位字母+7位数字组成,有时后面还有各省的简称。不过这个汉字的简称主要是方便体现受理的省局,没有的话对注册也影响不大。
前面4个字母的含义:
第一个字母:只有2种情况,分别代表国内注册(C)和进口注册(J)。
第二个字母:一般有4种情况,分别代表新药(X)、仿制药(Y)、补充申请(B)和再注册(Z)。
第三个字母:一般有4种情况,分别代表化药(H)、中药(Z)、生物制品(S)、辅料(F)。
第四个字母:一般有6种情况,分别代表申请生产或者销售(S,国内是申请生产,进口为申请销售),申请临床(L) ,进口分包装(F),补充申请 (B),再注册 (Z),复审(R)。
7位数字的含义:
前面2位是受理年份的后两位。后5位一般是流水号。需要注意的是紧挨着年份的2位数字的第一位如果是9的话就肯定不是流水号。这种受理号的形式与其他的区别很小,但是该号是企业完成生物等效性后直接寄国家局药审中心申请生产,由药审中心发的。
| 受理号 | 申请类型 |
| CYHL******* | 国内化药仿制药申请临床 |
| CYHS******* | 国内化药仿制药申请生产 |
| CYHS**9**** | 国内化药仿制药完成生物等效性后申请生产 |
| CYHB******* | 国内化药仿制药的补充申请 |
| CYHB**9**** | 国内化药仿制药完成生物等效性后的补充申请 |
| CBHR******* | 国内化药补充申请后申请复审 |
| CYHR******* | 国内化药仿制药申请 |
| CXHL******* | 国内化药新药申请临床 |
| CXHS******* | 国内化药新药申请生产 |
| CXHR******* | 国内化药新药申请复审 |
| CXHB******* | 国内化药新药补充申请 |
| CXHB**9**** | 国内化药新药补充申请后生物等效性报生产 |
| CYFS******* | 国内仿制辅料申请生产 |
| CYFB******* | 国内辅料补充申请 |
| CXFL******* | 国内新辅料申请临床 |
| CXFS******* | 国内新辅料申请生产 |
| CYSL******* | 国内生物制品仿制药申请临床 |
| CYSS******* | 国内生物制品仿制药申请临床 |
| CYSB******* | 国内生物制品补充申请 |
| CYSB**9**** | 国内生物制品补充申请批准生物等效性申请生产 |
| CYSR******* | 国内生物制品仿制药申请生产被否后复审 |
| CXSL******* | 国内生物制品新药申请临床 |
| CXSS******* | 国内生物制品新药申请生产 |
| CXSB******* | 国内生物制品新药补充申请 |
| CXSR******* | 国内生物制品新药申请复审 |
| CYZS******* | 国内中药仿制药申请生产 |
| CYZR******* | 国内中药仿制药申请复审 |
| CYZB******* | 国内中药生产补充申请 |
| CXZL******* | 国内中药新药申请临床 |
| CXZS******* | 国内中药新药申请生产 |
| CXZB******* | 国内中药补充申请 |
| CBZR******* | 国内中药补充申请被否后申请复审 |
| CXZR******* | 国内中药新药申请被否后申请复审 |
| JYHF******* | 化药仿制药申请进口分包装 |
| JYHB******* | 进口化药仿制药补充申请 |
| JYHZ******* | 进口化药再注册 |
| JXHL******* | 进口化药申请临床 |
| JXHS******* | 进口化药申请销售 |
| JXHR******* | 进口化药新药申请复审 |
| JXFL******* | 进口新辅料申请临床 |
| JYFB******* | 进口辅料补充申请 |
| JZHR******* | 进口化药再注册申请复审 |
| JYSF******* | 生物仿制药申请进口分包装 |
| JYSB******* | 进口生物仿制药补充申请 |
| JXSL******* | 进口生物药新药申请临床 |
| JXSS******* | 进口生物药新药申请销售 |
| JXSR******* | 进口生物药新药申请被否后申请复审 |
| JYSZ******* | 进口生物药再注册申请 |
| JYZB******* | 进口中药补充申请 |
| JXZL******* | 进口中药新药申请临床 |
| JXZR******* | 进口中药新药申请复审 |
| JYZZ******* | 进口中药再注册申请 |
| JZZR******* | 进口中药再注册被否后申请复审 |
二、药品批准文号
药品注册是指药品注册申请人依照法定程序和相关要求提出药物临床试验、药品上市许可、再注册等申请以及补充申请,药品监督管理部门基于法律法规和现有科学认知进行安全性、有效性和质量可控性等审查,决定是否同意其申请的活动。申请人取得药品注册证书后,为药品上市许可持有人。药品注册证书载明药品批准文号、持有人、生产企业等信息。
境内生产药品批准文号格式为:国药准字H(Z、S)+四位年号+四位顺序号。
中国香港、澳门和台湾地区生产药品批准文号格式为:国药准字H(Z、S)C+四位年号+四位顺序号。
境外生产药品批准文号格式为:国药准字H(Z、S)J+四位年号+四位顺序号。
其中,H代表化学药,Z代表中药,S代表生物制品。
药品批准文号,不因上市后的注册事项的变更而改变。中药另有规定的从其规定。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn