不对称脱氮环加成反应是构建手性氮杂环化合物的有效策略。然而,仅有一例关于苯并三唑与不饱和烷烃的不对称脱氮环加成反应的例子,可能是由于苯并三唑开环生成α-亚氨基金属类卡宾化合物在热力学上不利导致。近日,复旦大学张俊良课题组在JACS发表论文,报道了通过钯和手性磺酰胺膦配体的催化体系,实现苯并三唑与环/非环状1,3-二烯的不对称脱氮环加成反应,从而获得一系列高收率和高对映选择性的六氢咔唑和二氢吲哚衍生物。值得注意的是,使用具有相同绝对构型的Xu1和PC2还可获得一对对映异构体。此外,通过对六氢咔唑的后期修饰,进一步证明了反应的实用性。文章链接DOI:10.1021/jacs.1c07212
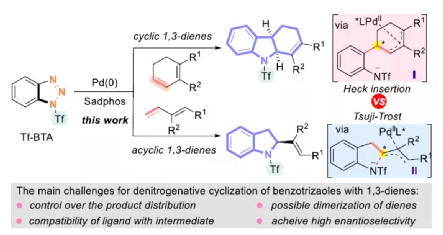
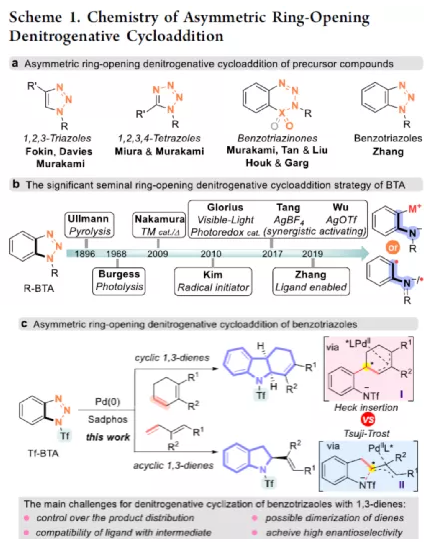
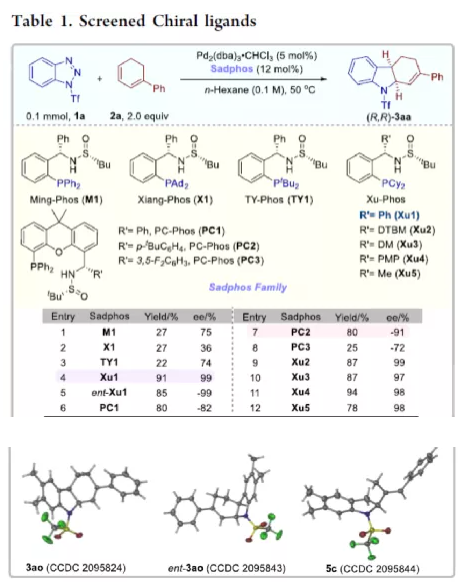
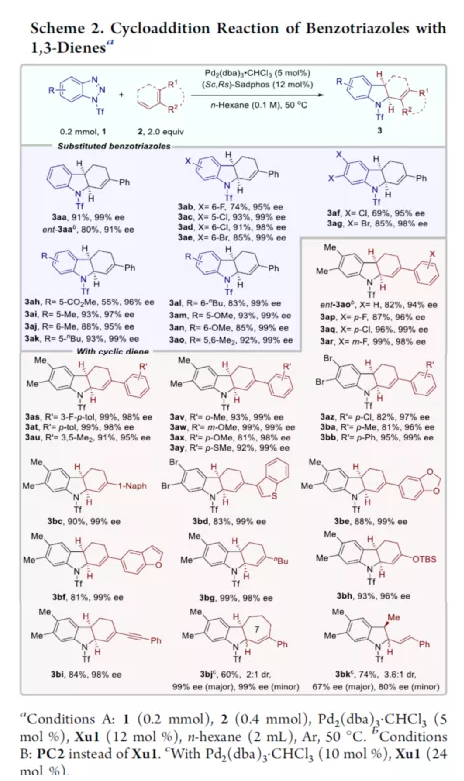
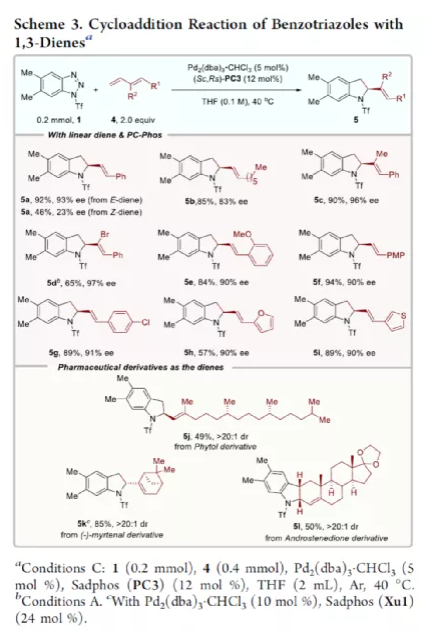
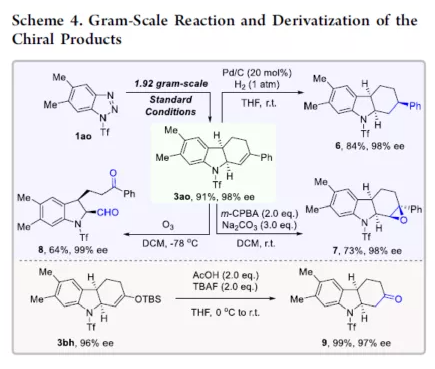
过渡金属催化不对称脱氮环加反应是构建手性氮杂环化合物的有效方法(Scheme 1a)。其中,Fokin课题组最早将手性铑催化剂用于1,2,3-三唑与不饱和化合物的不对称反应中。Murakami课题组还系统地研究了手性Ni/Box或铑配合物催化1,2,3-三唑、1,2,3,4-四唑或1,2,3-苯并三氮唑与不饱和化合物的不对称脱氮环加成反应。虽然已通过热解、光解、过渡金属催化、自由基引发剂、光氧化还原催化等策略实现苯并三唑的脱氮环加成反应,但对于不对称反应直到2019年才被探索(Scheme 1b)。在此,复旦大学张俊良课题组报道了一种1,3-二烯与苯并三唑的不对称串联脱氮Heck/Tsuji-Trost反应,从而合成一系列对映体富集的六氢咔唑和二氢吲哚衍生物(Scheme 1c)。值得注意的是,此类骨架广泛存在于生物活性单萜类吲哚生物碱中(Figure 1)。同时,该策略中还面临一些挑战:(1)可能发生Heck反应而不是Heck/Tsusj-Trost反应;(2)环/非环状1,3-二烯的立体决定步骤不同,前者是Heck插入步骤,后者是Tsuji-Trost亲核进攻步骤,其中可能需要不同类型的手性配体;(3)如何获得高区域选择性和对映选择性是一个难题,同时伴随着膦配体和重氮盐中间体的相容性问题。作者设想,合适的手性配体是克服这些困难的关键。下载化学加APP,阅读更有效率。首先,作者以1a与2a作为模型底物,对手性配体进行了大量的筛选(Table 1)。筛选结果表明,以Pd2(dba)3·CHCl3为催化剂,当使用Xu1配体时,可获得91%收率和99%ee的3aa。同时,当使用PC2配体时,可获得80%收率和91% ee的ent-3aa。上述结果表明,配体的主链和膦取代基的改变可调节产物的绝对立体构型,而R取代基的改变对于对映选择性影响不大。在获得上述最佳反应条件之后,作者开始对底物范围进行了扩展(Scheme 2)。首先,苯并三唑的芳基取代不受电子效应和定位效应的影响,均可顺利反应,获得相应的产物3aa-3ao,收率为55-93%,ee为95-99%。值得注意的是,当使用PC2配体时,可获得82%收率和94%ee的对映异构体ent-3ao。其次,芳基上含有各种取代基的芳基环己二烯底物,均与体系兼容,从而获得相应的产物3ap-3bb,收率为81-99%,ee为94-99%。值得注意的是,对于底物中含有溴取代基的底物,反应同样具有出色的对映选择性,如3az-3bb。此外,含有萘基、杂芳基、正丁基等取代的环己二烯底物,也可顺利反应,获得相应的产物3bc-3bh,收率为81-99%,ee为96-99%。对于含有炔基的环己二烯底物,同样可与体系兼容,从而获得84%收率的产物3bi,ee为98%,进一步表明该反应具有出色的化学选择性和对映选择性。对于环庚二烯和非末端二烯底物的环加成反应相对缓慢,分别获得60%收率的产物3bj(dr为2:1)和74%收率的产物3bk(dr为3.6:1)。此外,通过单晶X-射线分析,进一步确认产物的相对构型。紧接着,作者研究了苯并三唑与无环1,3-二烯(4)的脱氮Heck/Tsuji-Trost反应(Scheme 3)。然而在上述标准条件下反应,分别获得90%收率的ent-5a(ee为76%)和87%收率的5a(ee为80%)。因此,作者对反应条件进行了进一步的优化。当以Pd2(dba)3·CHCl3为催化剂,PC3为配体,可在THF的溶剂中40 ℃下反应,从而获得一系列二氢吲哚衍生物5a-5i,收率为57-94%,ee为83-97%。值得注意的是,在标准条件下,一系列药物衍生物(如叶绿醇、桃金娘烯醛和雄烯二酮)均可顺利反应,以中等收率和优异的非对映选择性获得相应的产物5j-5l。最后,作者还对反应的实用性进行了研究(Scheme 4)。首先,在标准条件下1ao的克级反应,可获得91%收率的产物3ao,ee为98%。其次,化合物3ao可进行多种后期修饰。例如,3ao中的双键通过Pd/C还原反应可获得化合物6,收率为84%,ee为98%。3ao中的双键也可通过环氧化反应可获得六氢咔唑7,收率为73%,ee为98%。3ao中的双键还可与臭氧进行选择性氧化断裂形成高度官能团化的二氢吲哚8,收率为64%,ee为99%。此外,化合物3bh经脱甲硅烷基化反应,可获得99%收率的手性酮9,ee为97%,为生物产品中常见的骨架。下载化学加APP,阅读更有效率。总结:复旦大学张俊良课题组报道了一种钯催化苯并三唑与环/非环状1,3-二烯的不对称脱氮Heck/Tsuji-Trost反应,从而获得一系列对映体富集的六氢咔唑和二氢吲哚衍生物。值得注意的是,使用具有相同绝对构型的Xu1和PC2或PC3还可获得一对对映异构体。此外,该策略具有反应条件温和、操作简单、化学选择性高、对映选择性高、收率高等特点。