- 首页
- 资讯
Nat. Commun.:十聚钨酸盐催化自由基二硫化反应合成非对称二硫化物
来源:化学加网原创 2022-07-15
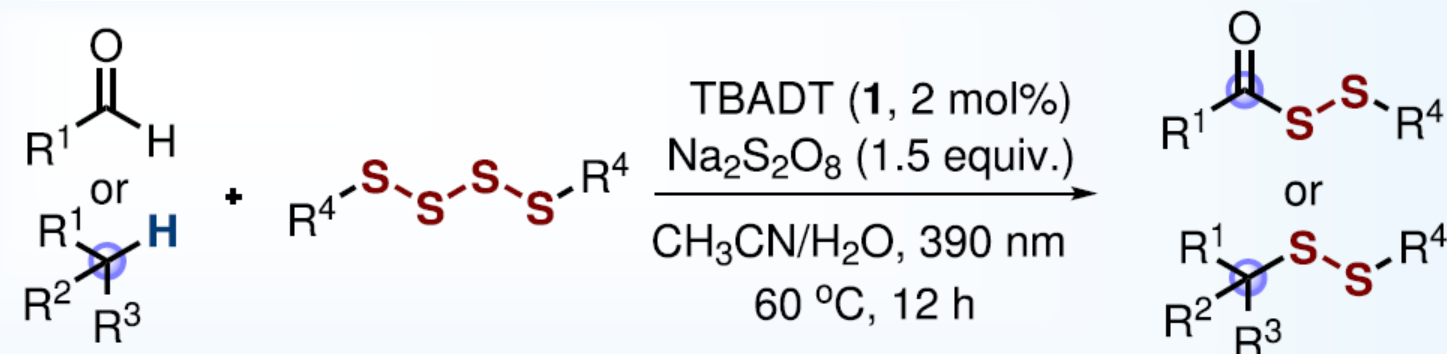
导读:近日,德国明斯特大学Armido Studer课题组报道了一种脂肪族C(sp3)-H键和醛类C(sp2)-H键转化为相应的C-SS键的策略。其中,使用四硫化物(RSSSSR)作为自由基二硫化试剂、十聚钨酸盐(decatungstate)阴离子([W10O32]4-)作为光催化剂、廉价的过硫酸钠(Na2S2O8)作为氧化剂,通过分子间氢原子转移可生成C-自由基。同时,通过该策略可直接合成一系列具有价值的酰基烷基二硫化物和非对称二烷基二硫化物。此外,通过对药物和天然产物的后期衍生化实验,从而进一步证明了反应的实用性。文章链接DOI:10.1038/s41467-022-31617-5。
由于二硫键在肽和蛋白质的折叠、稳定性和生物学功能方面的独特性质,二硫键在生物大分子中非常的重要。同时,二硫键还参与了生物系统,以维持细胞存活中的细胞氧化还原平衡。由于其独特的药理和理化性质,二硫键也存在于较低分子量的生物活性天然产物和药物中,例如抗真菌聚卡巴胺家族的成员,gombamide A、polycarpamine B和C、Z-ajoene、(-)-emethallicin E、psammaplin F 和kottamide E(Fig. 1)。此外,含有二硫键的化合物广泛存在于食品化学、制药工业、化学生物学以及聚合物科学领域。因此,对于二硫化物(特别是非对称二硫化物)的合成备受关注。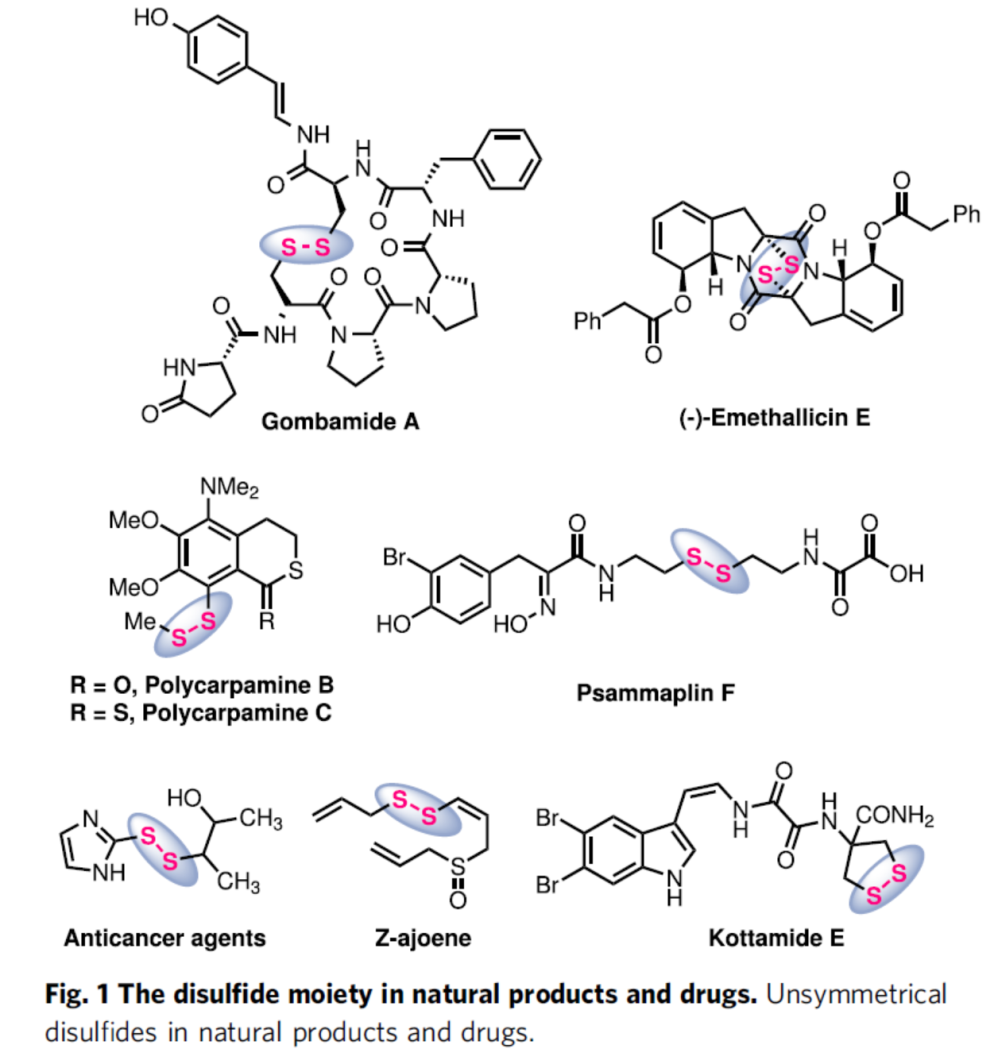
然而,对于构建二硫键的策略仍非常有限。目前,二硫化物的合成方法主要涉及通过S-S或C-SS键的构建过程(Fig. 2)非对称二硫化物可通过电氧化或光催化两种不同硫醇的氧化交叉偶联反应直接获得。然而,这些方法的化学选择性低,并存在同源偶联产物(对称二硫化物)。为了解决选择性问题,可通过使用离子方法,即选择带有阴离子离去基团(LG)的硫衍生物作为亲电子试剂以及硫醇作为亲核试剂。沿着这些思路,二硫化物交换反应是目前制备非对称二硫化物最常用的方法。考虑到C-SS键的形成,该策略受益于亲电和亲核“masked”二硫化试剂的开发。同时,此类反应通常通过金属催化的交叉偶联或取代反应进行。并且,在这些双硫化过程中,一种反应组分带有两个硫原子,使得该方法对于制备非对称二硫化物具有价值。然而,由于二硫试剂的制备繁琐过程,导致反应的实用性受到限制。近些年来,自由基化学备受关注,可在温和条件下实现化学键的有效构建。最近,Pratt课题组利用四硫化物或三硫化物-1,1-二氧化物作为C-自由基受体进行自由基取代反应,成功合成了多种非对称二硫化物,其中利用S-S键固有的裂解倾向生成热力学稳定的RSS•或磺酰基自由基。2021年,王兮课题组也报道了一种无金属催化苯胺的二硫化反应。在这些反应中,C-自由基中间体是由官能团化反应生成,同时生成额外的副产物。2021年,Pratt课题组报道了一种通过Hofmann-Löffler-Freytag类型化学进行优雅的区域选择性自由基C-H键的二硫化反应,其中通过分子内1,5-HAT到N-中心自由基从而生成C-自由基。然而,通过分子间HAT过程形成C-SS键的方法,仍有待进一步的开发。在此,德国明斯特大学Armido Studer课题组开发了一种更为原子经济性的自由基二硫化策略,该策略无需预功能化的自由基前体,通过使用氢原子转移(HAT)催化剂可直接进行C-H键官能团化反应。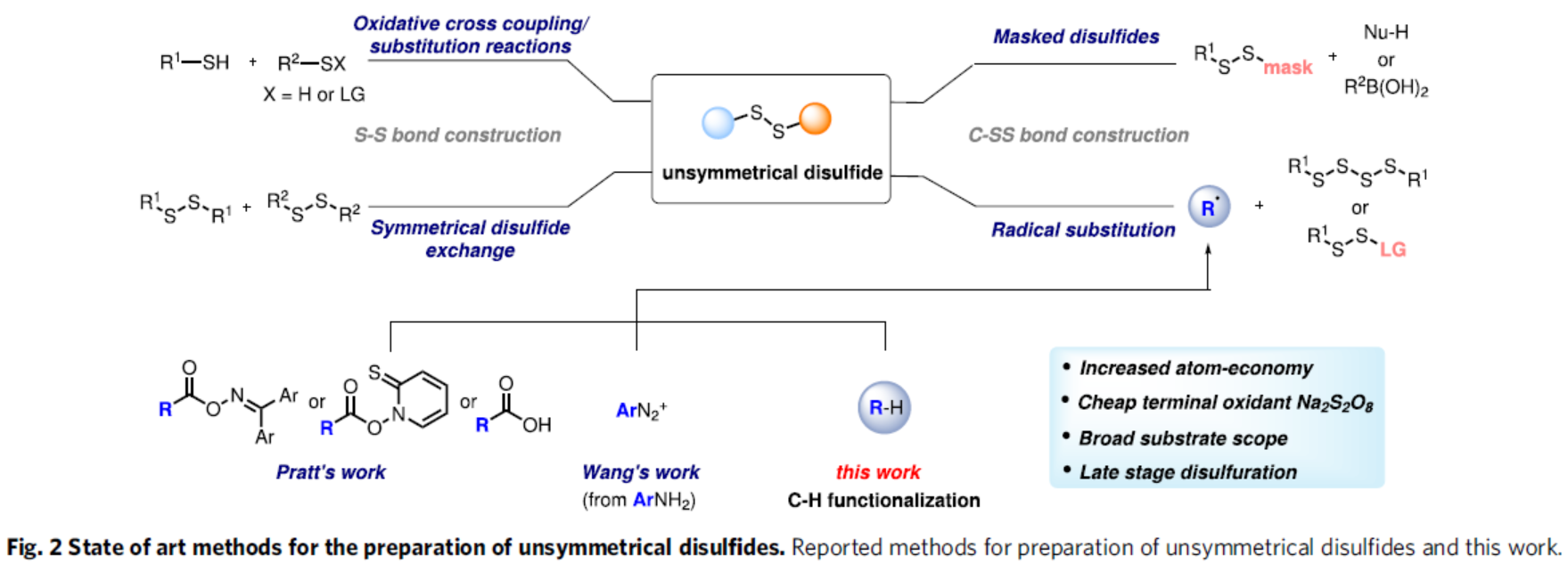
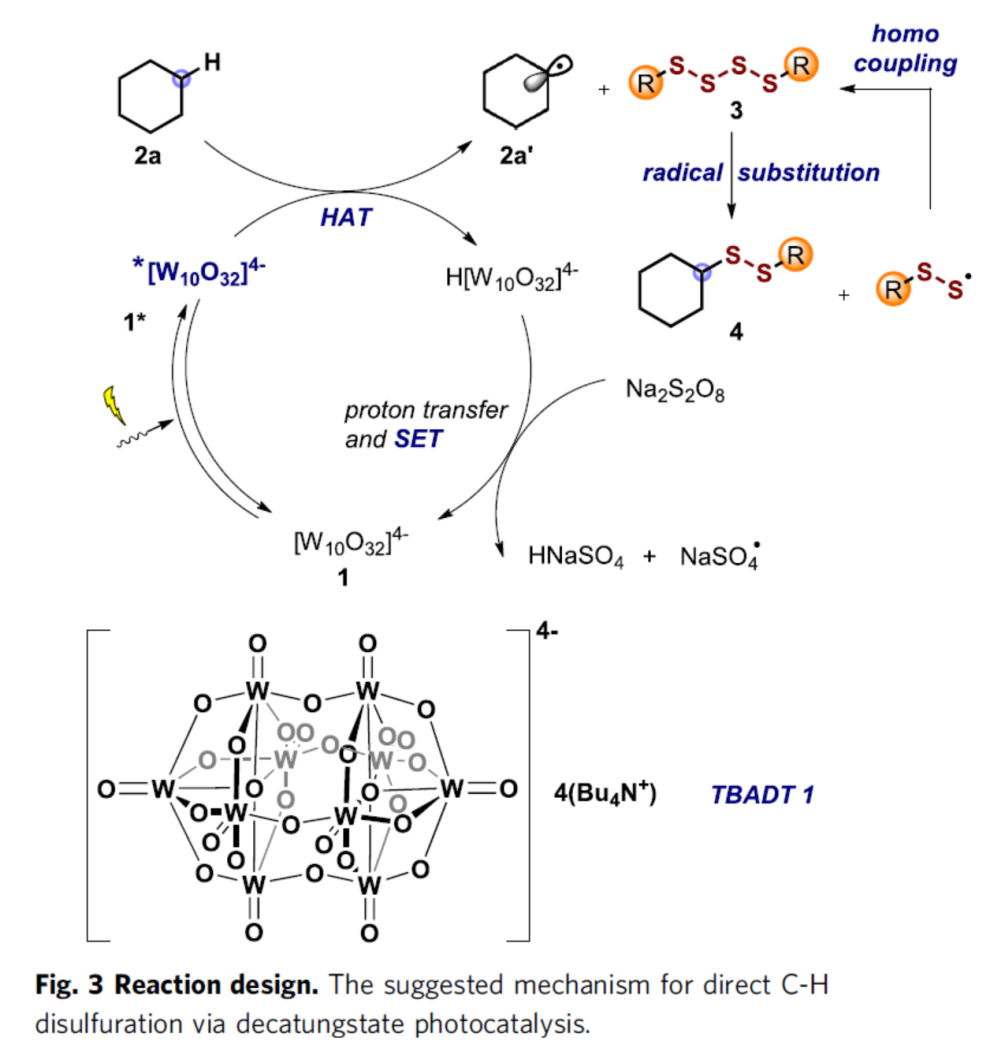
近年来,光催化已成功应用于氢原子转移(HAT)介导的C-H键自由基官能团化反应。在HAT的光催化剂中,具有缺电子氧原子的十聚钨酸盐阴离子 ([W10O32]4-)已被广泛的探索,由于其能够催化裂解强的惰性脂肪族C(sp3)-H键。因此,Studer课题组选择了十钨酸四丁基铵1(TBADT,tetrabutylammonium decatungstate)作为光催化剂,以实现直接的分子间自由基C-H键的二硫化反应。首先,十聚钨酸盐阴离子1在光辐射下生成反应激发态1*,可与2a经HAT生成环己基自由基2a'以及H[W10O32]4-。这种烷基自由基很容易被四硫化物3捕获,生成目标二硫化产物4和相应的热力学稳定的RSS•(易于二聚化生成四硫化物3)。此外,光催化循环将通过H[W10O32]4-的去质子化来关闭循环,并生成[W10O32]5-,然后通过单电子转移(SET)将其氧化以再生十聚钨酸盐阴离子1。
首先,作者以环己烷2a与四硫化物3a作为模型底物,进行了相关反应条件的筛选(Table 1)。当以TBADT作为光催化剂,Na2S2O8作为氧化剂,在乙腈/水(2:1)的混合溶剂中于390 nm辐射下60 oC反应12 h,可以86%的收率得到二硫化产物4a。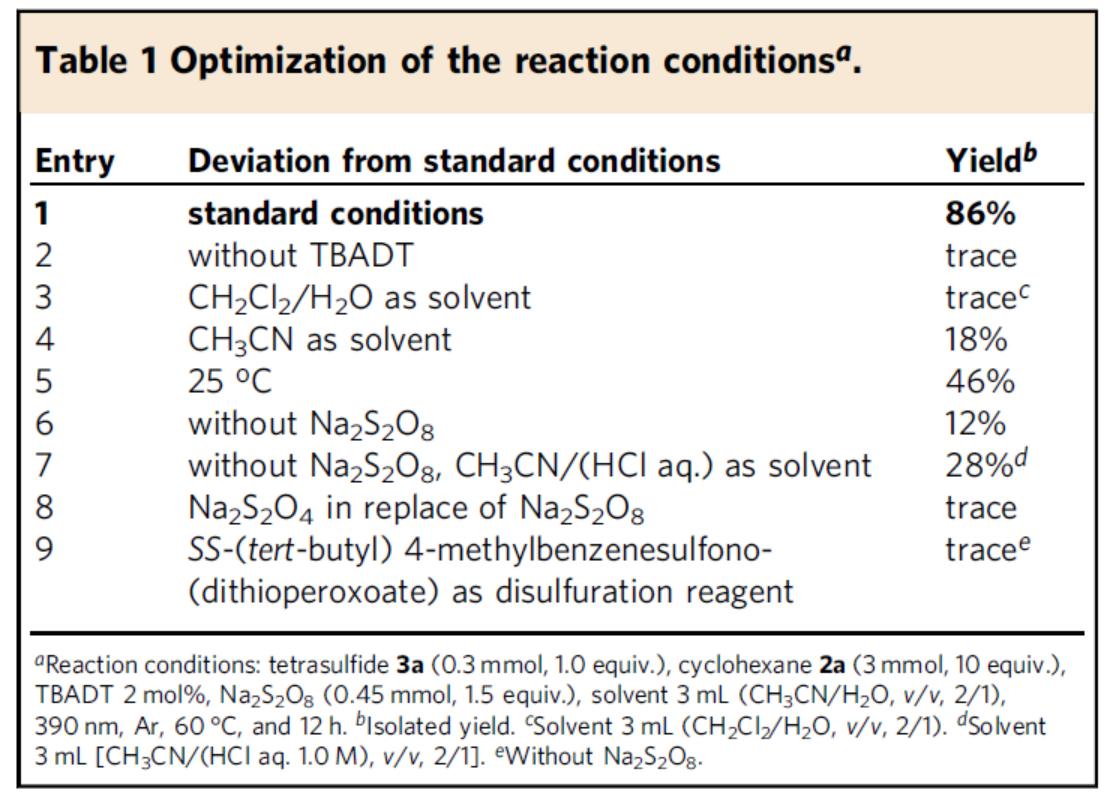
在获得上述最佳反应条件后,作者合成了一系列不同取代的四硫化物3a-3l,并对底物范围进行了扩展(Fig. 4)。首先,当以环己烷(2a)作为自由基前体,可与一系列不同取代的四硫化物反应,获得中等至高收率的相应产物4a-4k'。其对于二苯基四硫化物3i,没有形成目标产物4i,但获得72%收率的单硫化物4i。在无Na2S2O8氧化剂时,除了单硫化物4i'(37%)之外,反应还生成了二硫化物4i(26%)作为次要产物。双苯甲酰四硫化物3j也出现了类似的结果。其次,一系列不同的C-自由基前体,均可顺利进行反应,获得相应的产物4d-4bb,收率为32-86%。值得注意的是,反应具有良好的区域选择性,如4o-4bb。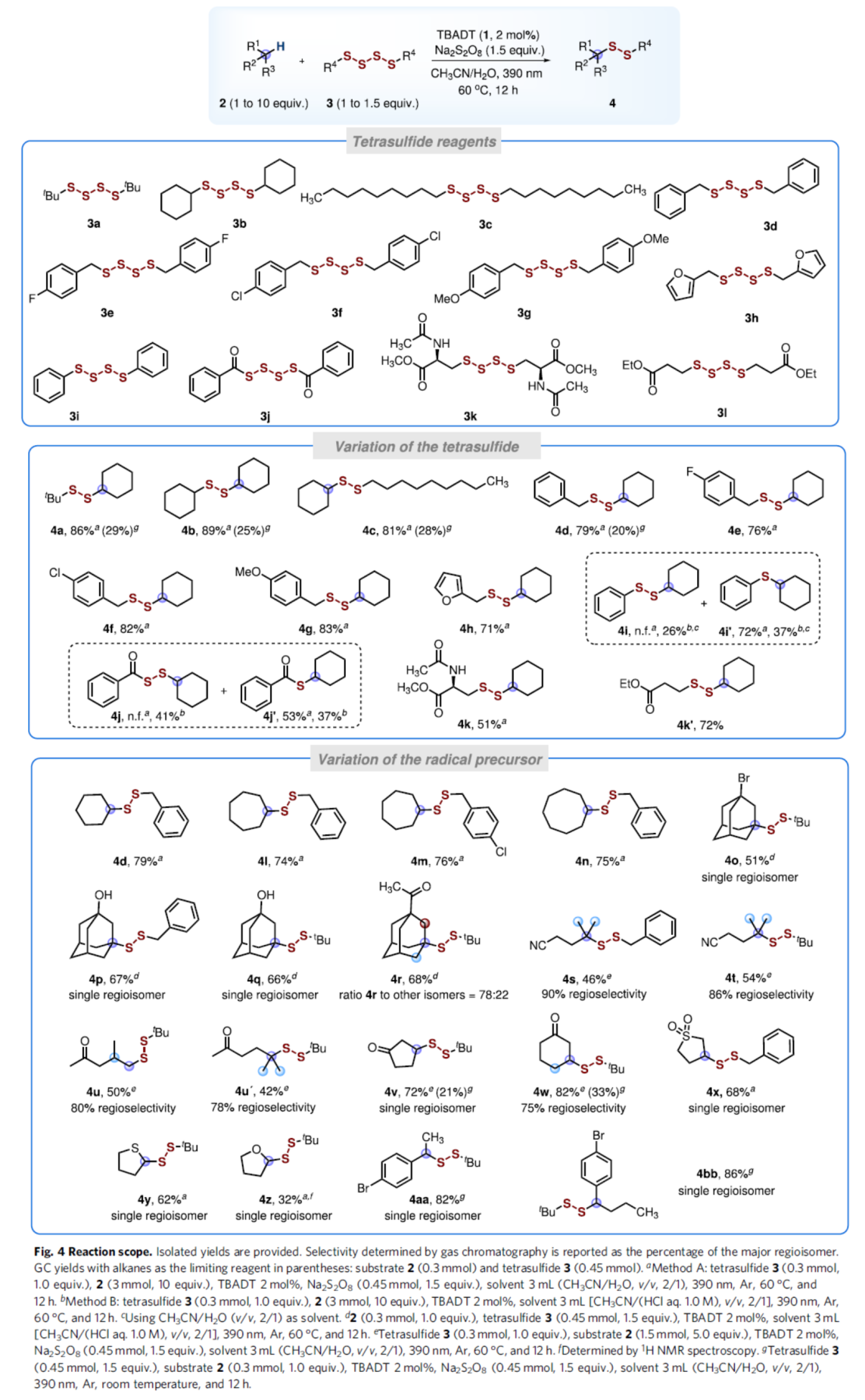
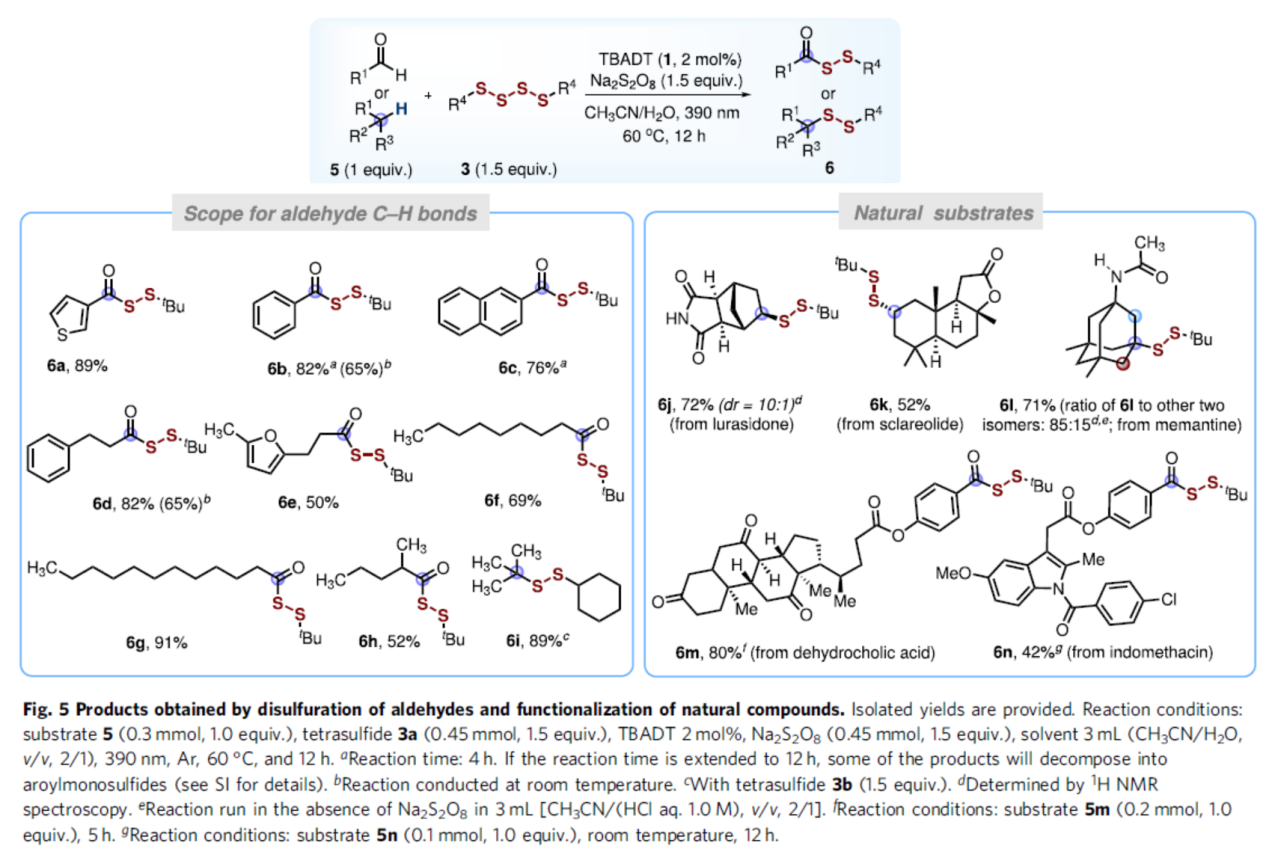
同时,作者发现,一系列不同的醛可作为酰基自由基前体,可与四硫化物3顺利反应,获得相应的产物6a-6i,收率50-91%(Fig. 5)。值得注意的是,该策略还可用于一些天然产物分子的后期衍生化实验,获得相应的产物6j-6n,收率为42-80%。
为了进一步证明反应的实用性,作者还进行了克级规模实验,并以84%的收率获得产物4a和88%的收率获得产物6g(Fig. 6a)。同时,作者还对反应机理进行了研究(Fig. 6b)。首先,在5f与3a的标准反应体系中加入TEMPO时,二硫化产物6f的收率降低至49%,并通过HRMS检测到TEMPO加合物7的生成。同时,在2a与3a的标准反应体系中加入TEMPO时,反应完全被抑制,且获得21%收率的TEMPO加合物8。上述结果表明,该反应涉及自由基的机理,并且在光催化下生成相应的烷基和酰基自由基。此外,在2a与3a的标准反应体系加入两当量的丙烯酸甲酯,可获得自由基串联产物9和4a,从而进一步支持反应涉及自由基的机理。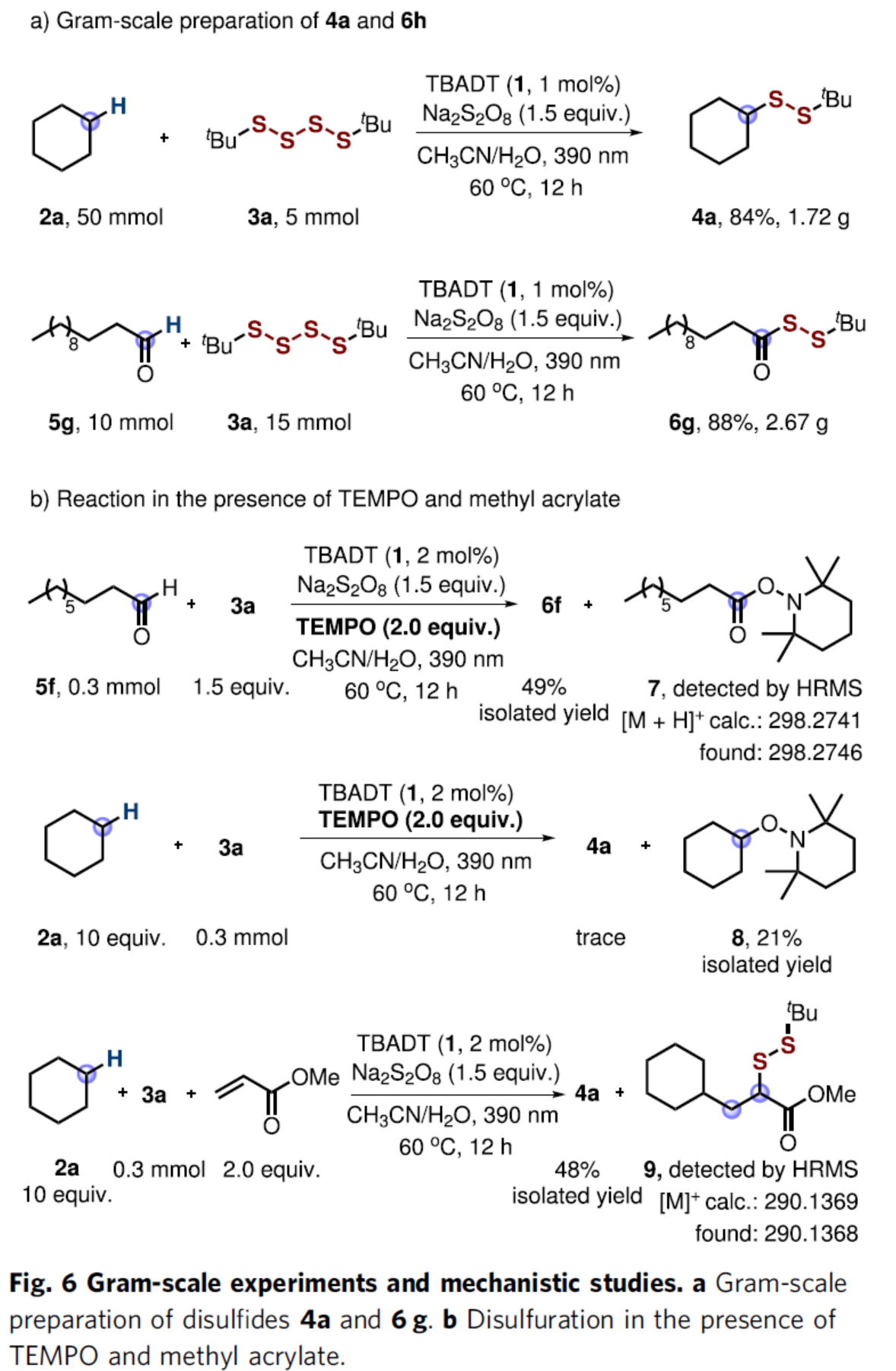
总结:德国明斯特大学Armido Studer课题组报道了一种十聚钨酸盐催化自由基C-H键的二硫化策略,合成了一系列非对称二硫化物。其中,使用易制备的四硫化物作为C-自由基捕获剂。在空间位阻和电子效应的引导下,通过HAT的C-H官能团化在简单和更为复杂的烷烃上具有高区域选择性。此外,该策略还适用于芳香族和脂肪族醛的二硫化反应,具有完全区域选择性,并合成了非对称的酰基二硫化物。此外,通过对药物和天然产物的后期衍生化实验,从而进一步证明了反应的实用性。
文献详情:
Jingjing Zhang & Armido Studer .Decatungstate-catalyzed radical disulfuration through direct C-H functionalization for the preparation of unsymmetrical disulfides.Nat. Commun.2022.https://doi.org/10.1038/s41467-022-31617-5。

声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn










