

正文
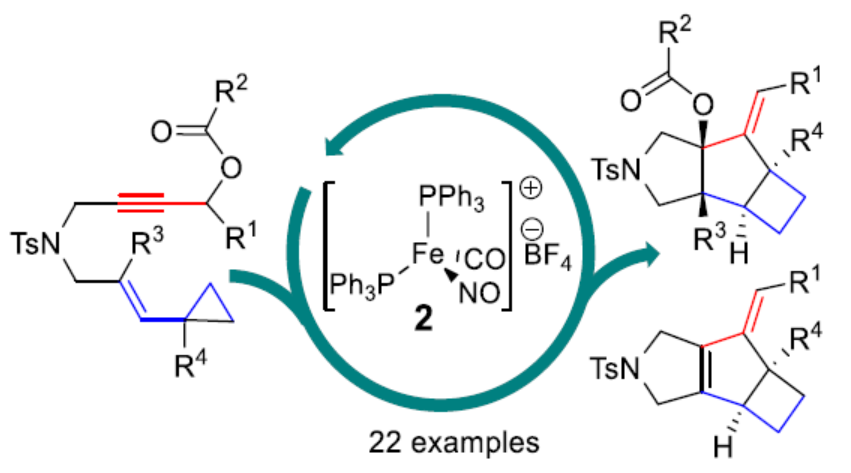
近日,德国斯图加特大学Bernd Plietker课题组报道了一种新型的环丙基取代烯炔衍生物的环异构化(cycloisomerizations)过程,涉及将环异构化与环丙烷中C-C键的活化相结合。其中,使用[(Ph3P)2Fe(CO)(NO)]BF4作为催化剂,在温和的条件下合成了一系列非天然(non-canonical)三环环丁烷衍生物,具有良好的收率以及高立体控制性。
(图片来源:Angew. Chem. Int. Ed.)
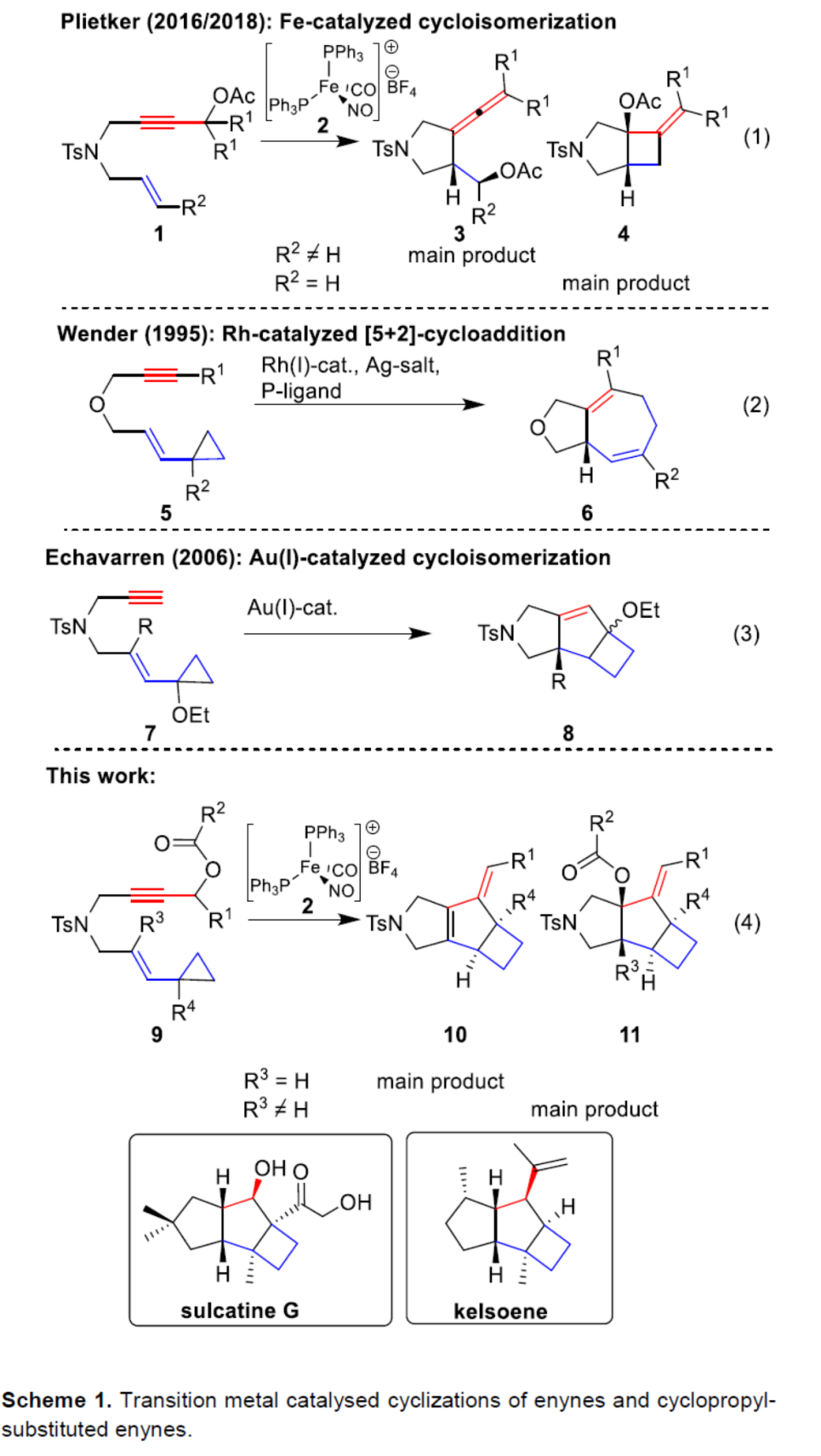
通过简单易得的起始原料,经环异构化策略,可直接构建结构复杂的环化化合物。在该领域,化学家们主要集中在Rh-和Ir-配合物催化的研究。同时,作为π-Lewis酸催化剂的Au(I)-配合物为该领域开辟了一个全新的方向。最近,Plietker课题组报道了一种阳离子16-电子Fe(0)-配合物[(Ph3P)2Fe(CO)(NO)]BF4(2)可作为π-Lewis酸催化剂,可实现烯炔乙酸酯或芳基烯基酮的氧化还原中性环异构化(eq. 1)。早在1995年,Wender或Shintani/Hayashi课题组开创性使用Rh-配合物实现环丙基取代烯炔(5)的环异构化,获得了形式[5+2]-环加成产物(eq. 2)。2006年,Echavarren课题组使用Au(I)-配合物作为π-Lewis-酸,实现了环丙基取代的烯炔(7)的环异构化,获得环异构化-Prins-环化的稠合三环产物8(eq. 3)。近日,德国斯图加特大学Bernd Plietker课题组报道了阳离子铁配合物[(Ph3P)2Fe(NO)(CO)]BF4催化环丙基取代烯炔的环异构化-C-C键活化的策略,构建了一系列复杂的三环n,5,4-骨架(存在于天然产物中,如sulcatine G或kelsoene)(Scheme 1)。
(图片来源:Angew. Chem. Int. Ed.)
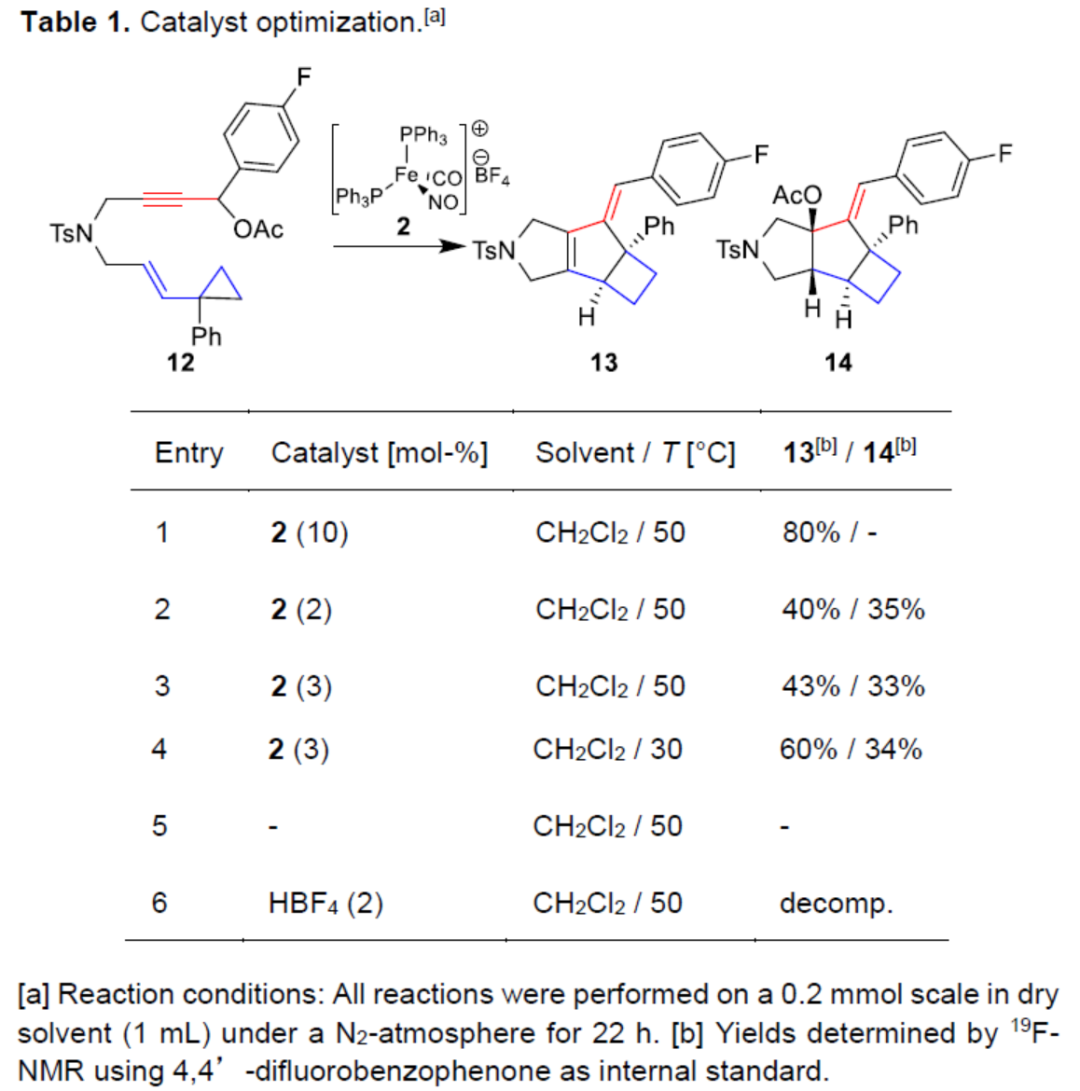
首先,作者以环丙基取代的烯炔衍生物12作为模型底物,进行了相关环异构化反应条件的筛选(Table 1)。当以[(Ph3P)2Fe(NO)(CO)]BF4(2)作为催化剂,在CH2Cl2溶剂中50 oC下反应22 h,可以80%的收率得到三环产物13。
(图片来源:Angew. Chem. Int. Ed.)
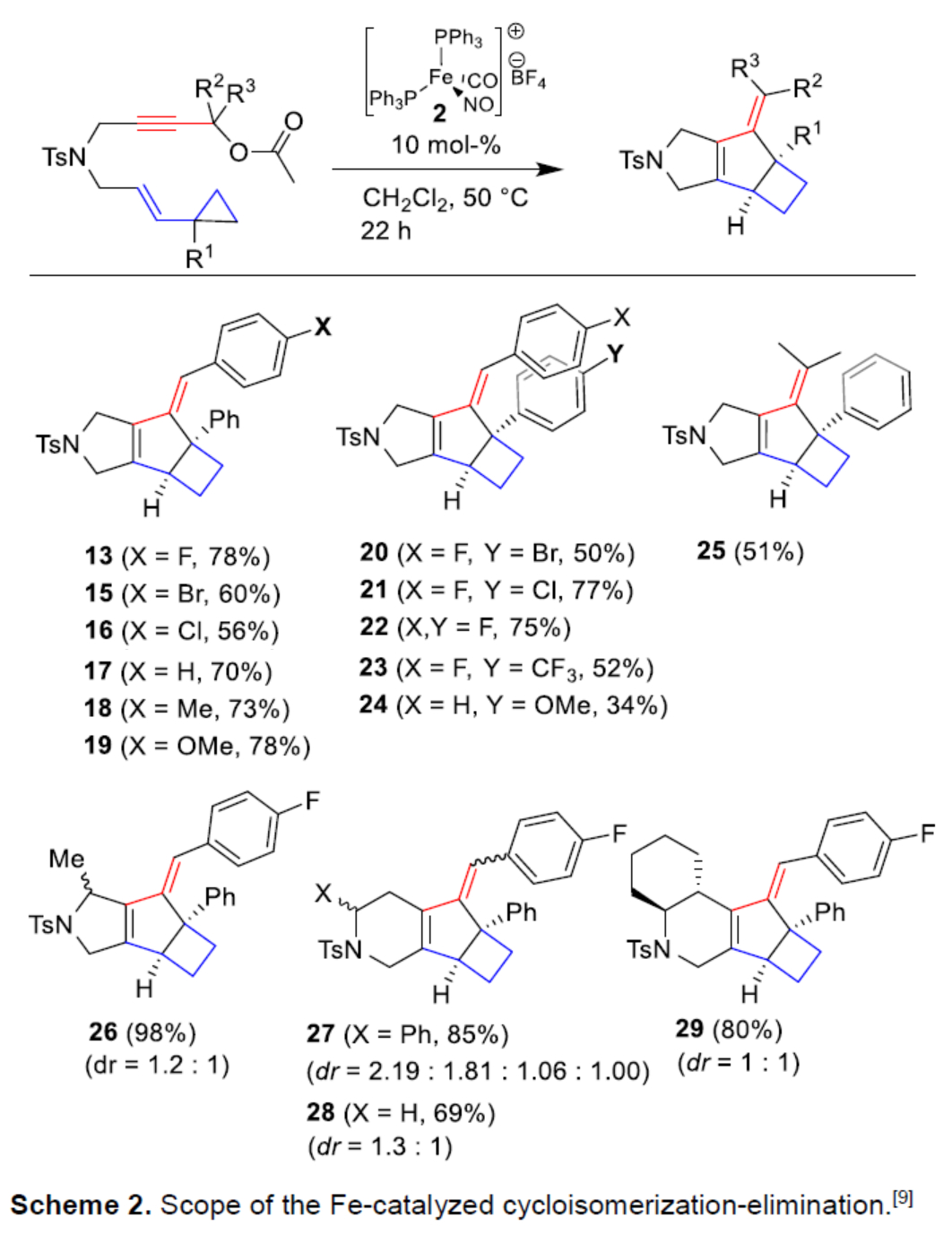
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Scheme 2)。研究表明,一系列不同取代的环丙基烯炔衍生物,均可顺利进行反应,获得相应的稠合三环环丁烷产物13-29,收率为34-98%。其中,含有卤素、烷氧基和酰胺基取代的底物,均与体系兼容。同时,当使用多取代的高炔丙基酰胺时,可以良好的收率生成四环稠合化合物29。p-取代基Y的性质,对于反应的收率有着显著的影响(13-19 vs. 20-24)。+M-取代基,可增加产物13-19的收率,从而表明在炔丙基乙酸酯活化过程中需要稳定部分正电荷,而环丙烷单元中芳基对位取代则相反(20-24)。因此,催化剂控制的环丙烷C-C键活化的方向,而不是碳阳离子(Wagner-Meerwein型)开环反应的方向。
(图片来源:Angew. Chem. Int. Ed.)
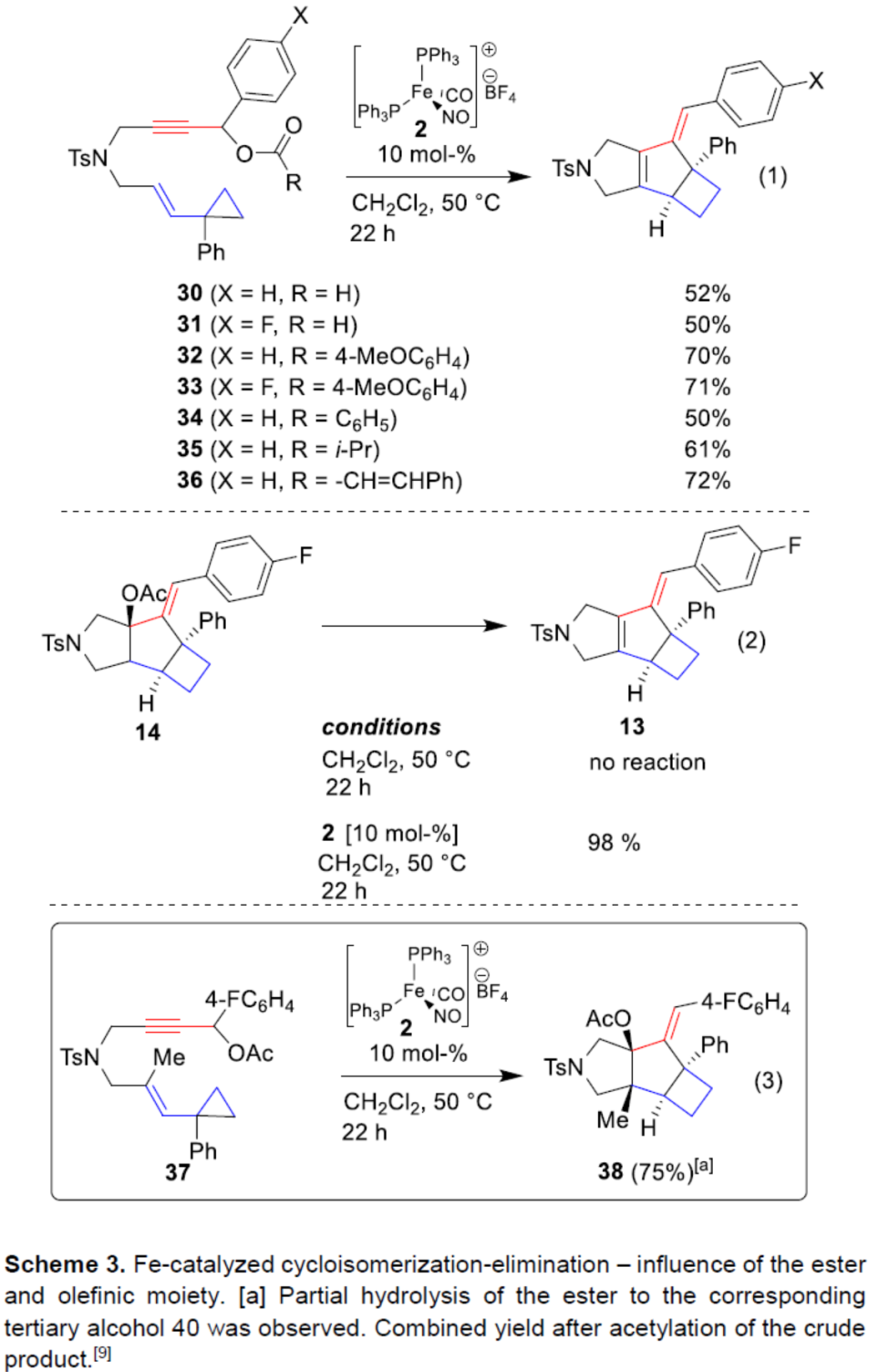
由于上述产物13-29的形成过程,涉及环异构化和随后消除两步过程,作者认为,底物中酯基单元的改变,可能会减缓消除过程,从而获得相应的烯丙基乙酸酯(allylic acetate)(Scheme 3)。因此,作者合成了一系列炔丙醇酯(propargylic esters)衍生物30-37,并在标准条件下反应,均可顺利反应(除了新戊酸酯以外)。同时,在反应过程中观察到二烯13或17的快速消除(eq. 1)。为了了解铁配合物是否催化了快速消除过程,作者在有无催化剂2的情况下进行14的反应,分别获得定量收率的二烯13以及未发生反应(eq. 2)。因此,不易消除的三取代烯烃35进行环异构化时,可以75%的收率生成非对映体纯的化合物36(eq. 3)。
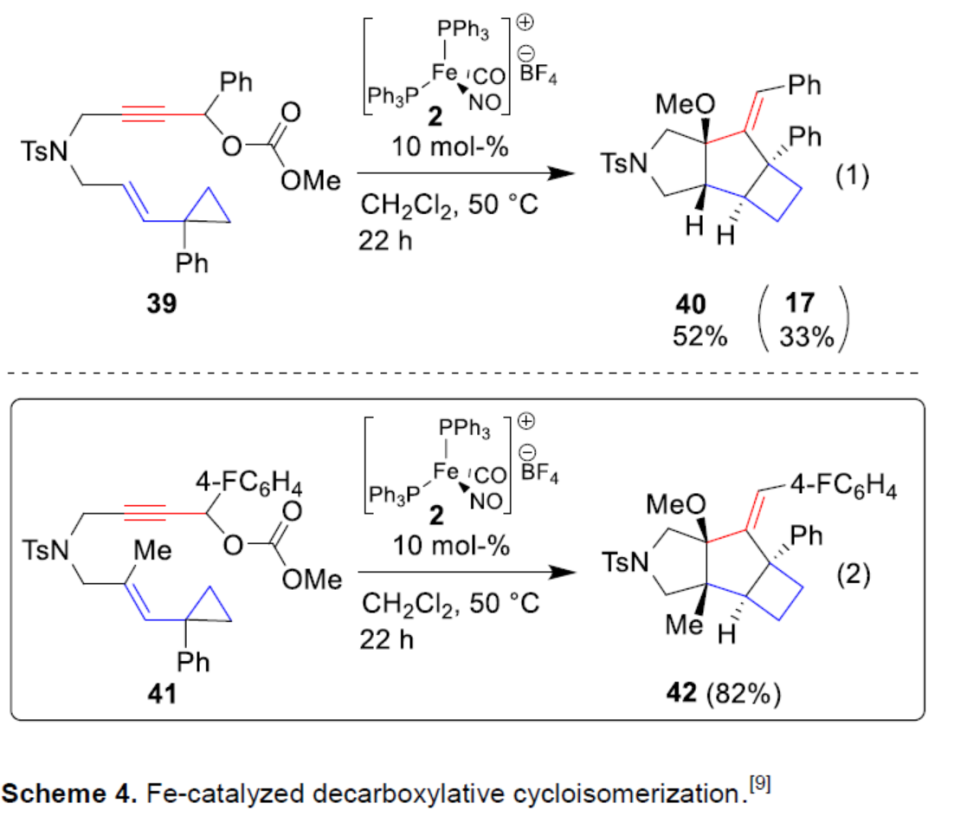
在过渡金属催化的Tsuji-Trost型烯丙基化反应中,烯丙基烷基碳酸酯具有高反应性。与使用烯丙基乙酸酯相比,离去基团可快速脱羧,生成相应的醇盐,该醇盐充当碱或亲核试剂。令人高兴的是,当使用炔丙基烷基碳酸酯作为起始底物,可减缓消除过程,可以52%的收率获得醚化合物40以及33%收率的二烯副产物17(Scheme 4)。同时,当使用三取代烯烃底物41时,可以82%的收率获得烯丙基醚化合物42。
(图片来源:Angew. Chem. Int. Ed.)
(图片来源:Angew. Chem. Int. Ed.)
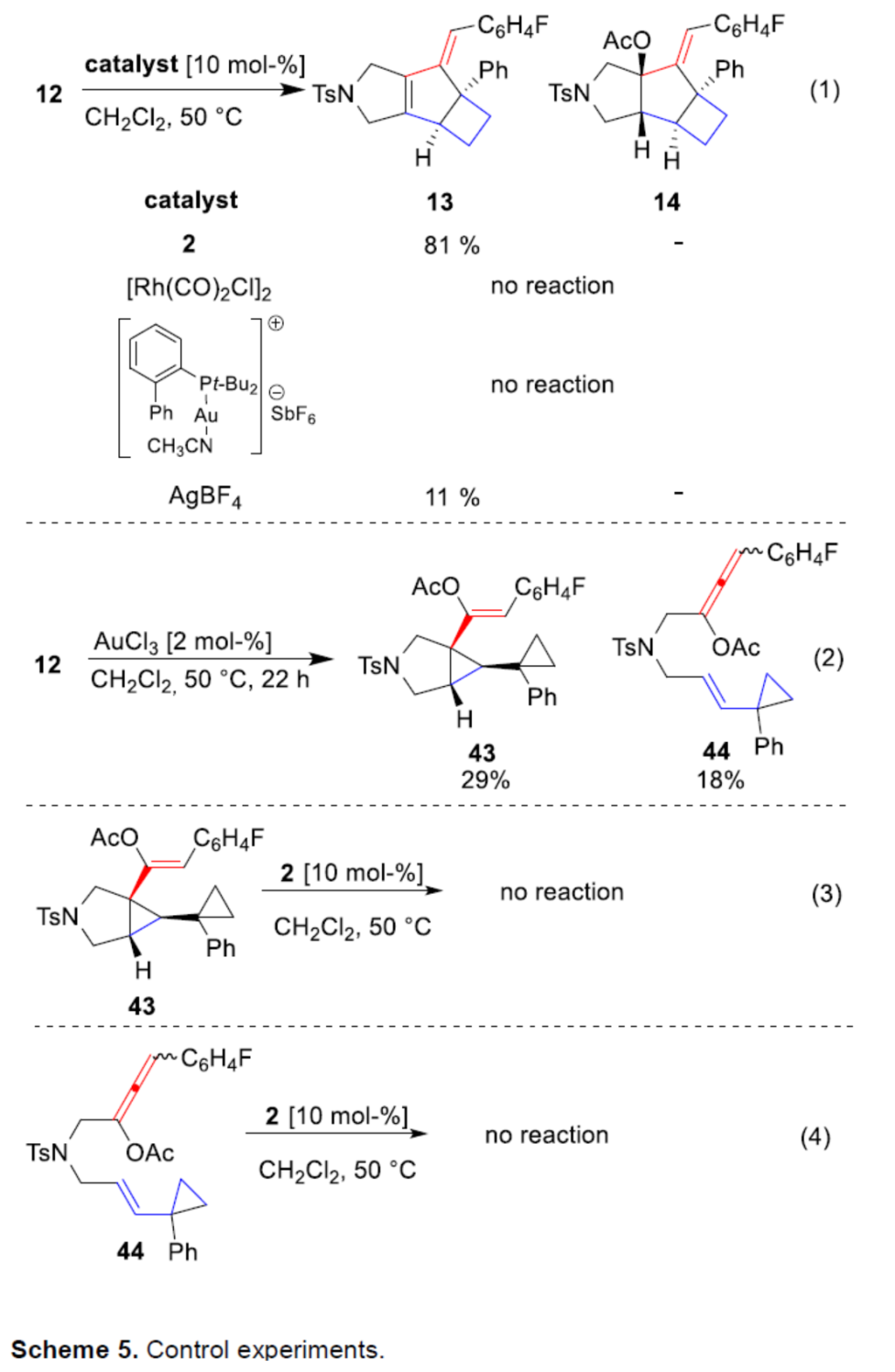
此外,作者还对反应机理进行了进一步的研究(Scheme 5)。首先,12在标准条件下使用不同的催化剂时,仅在使用AgBF4时,才能获得11%收率的产物13。同时,使用AuCl3作为催化剂时,可同时获得化合物43与联烯化合物44,且环丙基单元保持不变。此外,将43和44在标准条件下反应,均未发生反应,从而排除了作为潜在中间体的可能性。
(图片来源:Angew. Chem. Int. Ed.)
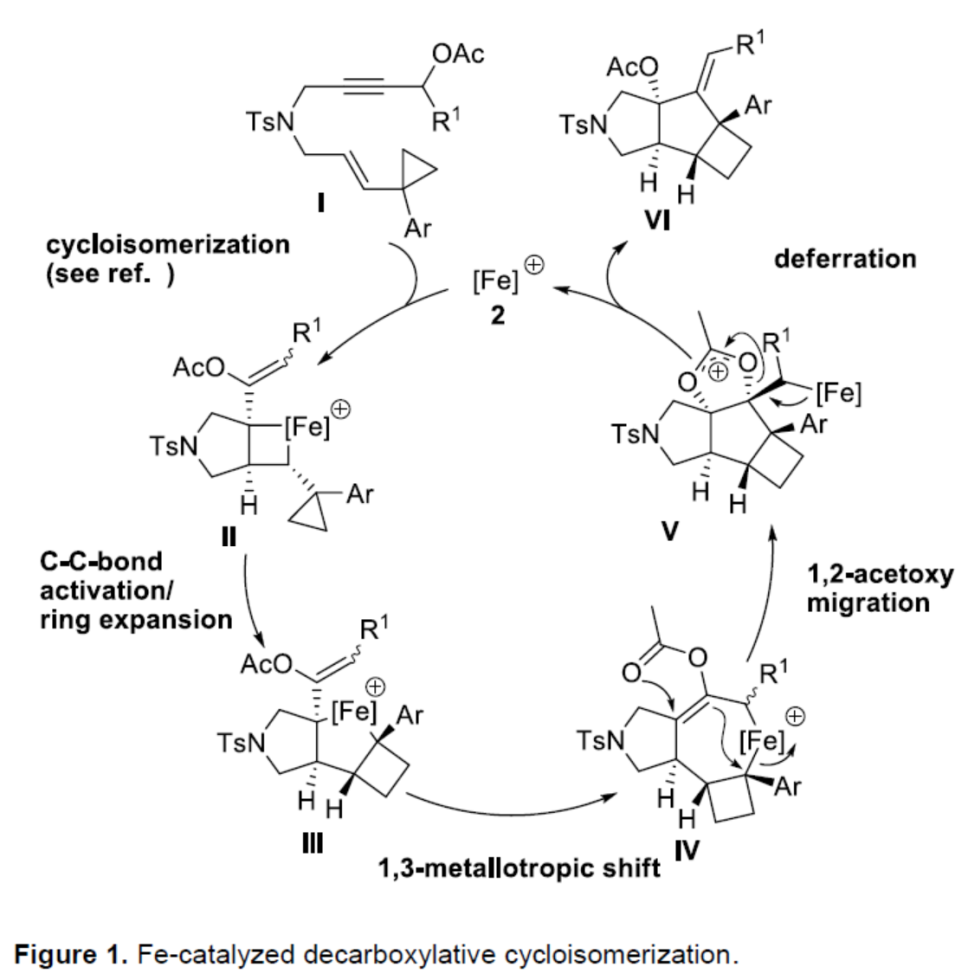
基于上述的研究以及相关文献的查阅,作者提出了一种合理的催化循环过程(Figure 1)。首先,阳离子铁配合物与底物中的炔基配位,生成环丙基取代的金属环丁烷中间体II。其次,阳离子铁中心促进II经以金属为中心的C-C键的活化扩环过程,同时释放环张力,生成中间体III。中间体III经1,3-Metallotropic迁移、1,2-乙酰氧基迁移以及铁消除(deferration)过程,可生成产物VI和再生催化剂2,从而完成催化循环过程。
(图片来源:Angew. Chem. Int. Ed.)
总结
德国斯图加特大学Bernd Plietker课题组报道了一种新型的环丙基取代烯炔衍生物的环异构化过程,涉及将环异构化与环丙烷中C-C键的活化相结合。其中,使用[(Ph3P)2Fe(CO)(NO)]BF4作为催化剂,可在温和的条件下合成一系列稠合三环环丁烷衍生物,具有良好的收率以及高立体控制性。有趣的是,在测试的不同贵金属类型催化剂中,只有AgBF4表现出相似的反应性,尽管收率较低。
文献详情:

声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn