

正文
羰基叶立德作为一种高活性的有机合成中间体被广泛应用于氧杂环骨架的构建,其中金属卡宾与羰基化合物的环氧化反应作为一种构筑环氧乙烷骨架的有效手段,自从2001年由Michael P. Doyle教授首次系统报道以来引起了化学家们极大的研究兴趣。然而,该领域的不对称催化问题长期以来没有得到很好的解决,究其原因主要是原位生成的羰基叶立德中间体上的金属催化剂的解离速度远远快于环化速度。因此,直接通过金属催化剂上的手性配体来调控产物的立体选择性极具挑战性(图1a)。
近日,叶龙武教授课题组基于先前课题组有关铜催化1,5-二炔不对称环化反应(J. Am. Chem. Soc. 2019, 141, 16961; J. Am. Chem. Soc. 2020, 142, 7618; Chem. Sci. 2021, 12, 9466; Angew. Chem. Int. Ed. 2022, 61, e202115554)的研究基础,以廉价金属铜作为催化剂,以上海有机所唐勇院士课题组发展的带有大位阻边臂的双噁唑啉作为手性配体,通过远程立体化学控制策略,成功实现了1,5-二炔与羰基化合物经由羰基叶立德中间体的不对称环化反应,并且在该工作中首次实现了烯基阳离子对羰基的捕获(图1b)。
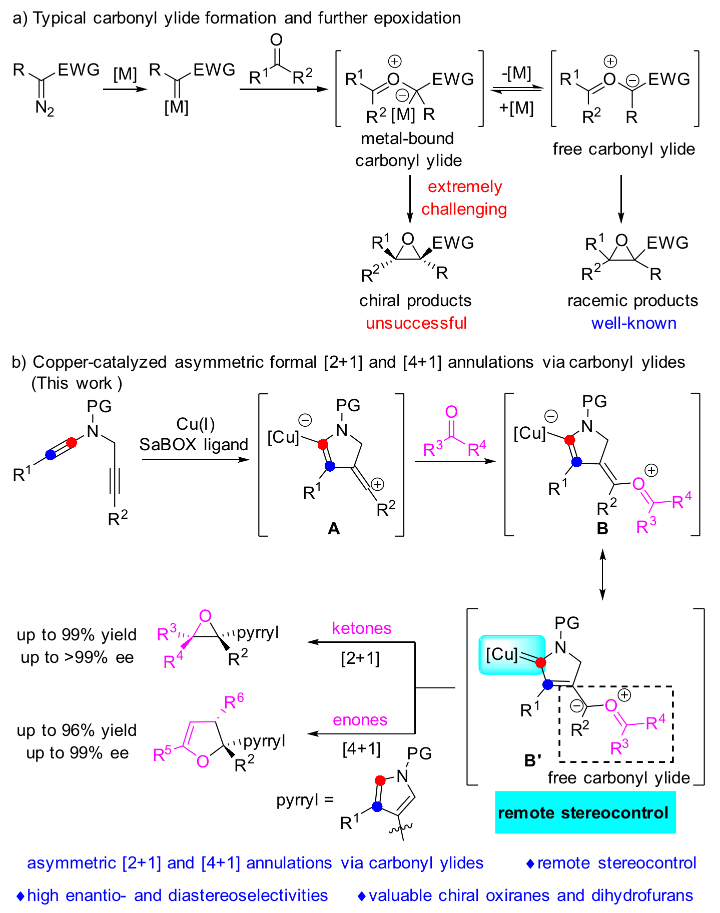
图1. 经由羰基叶立德的环氧化反应(图片来源:Angew. Chem. Int. Ed.)
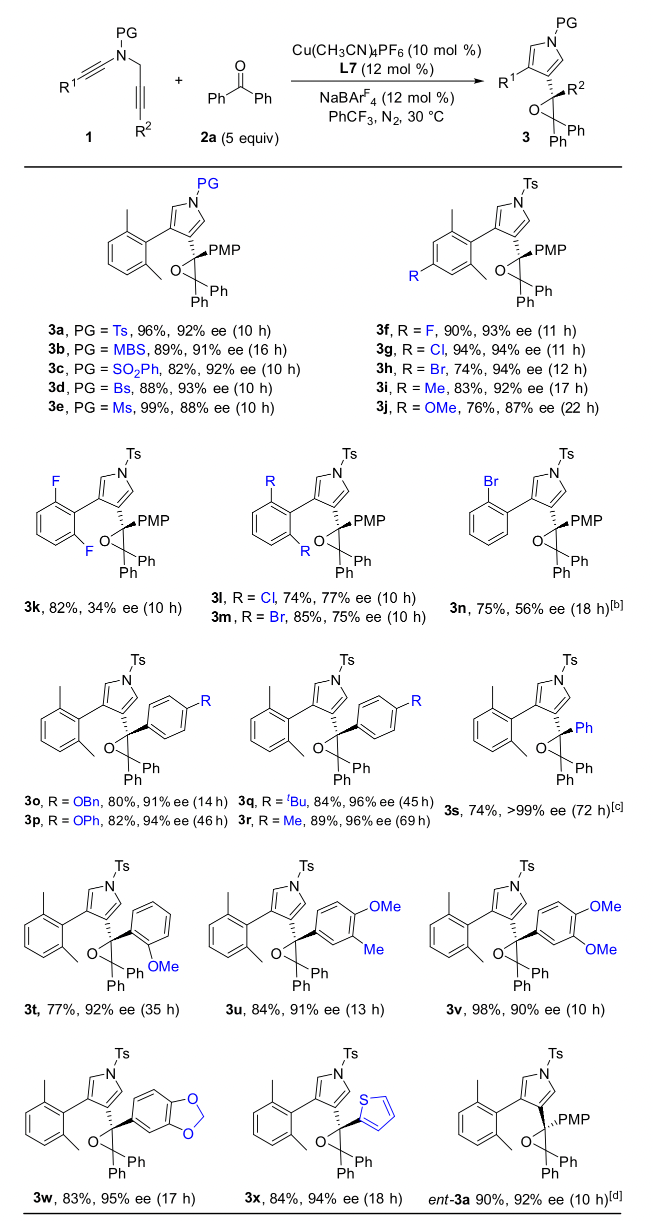
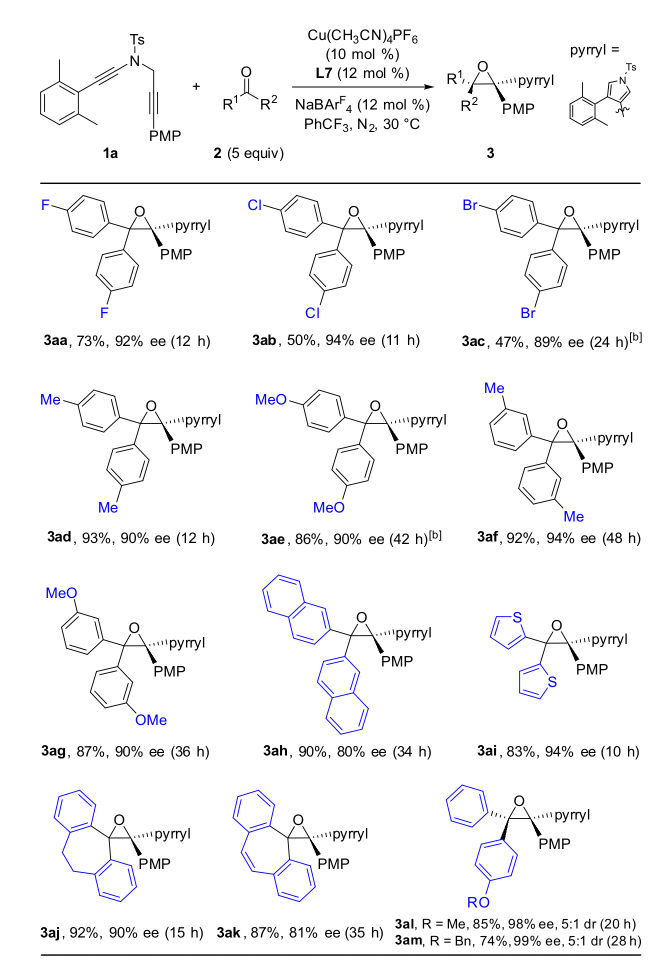
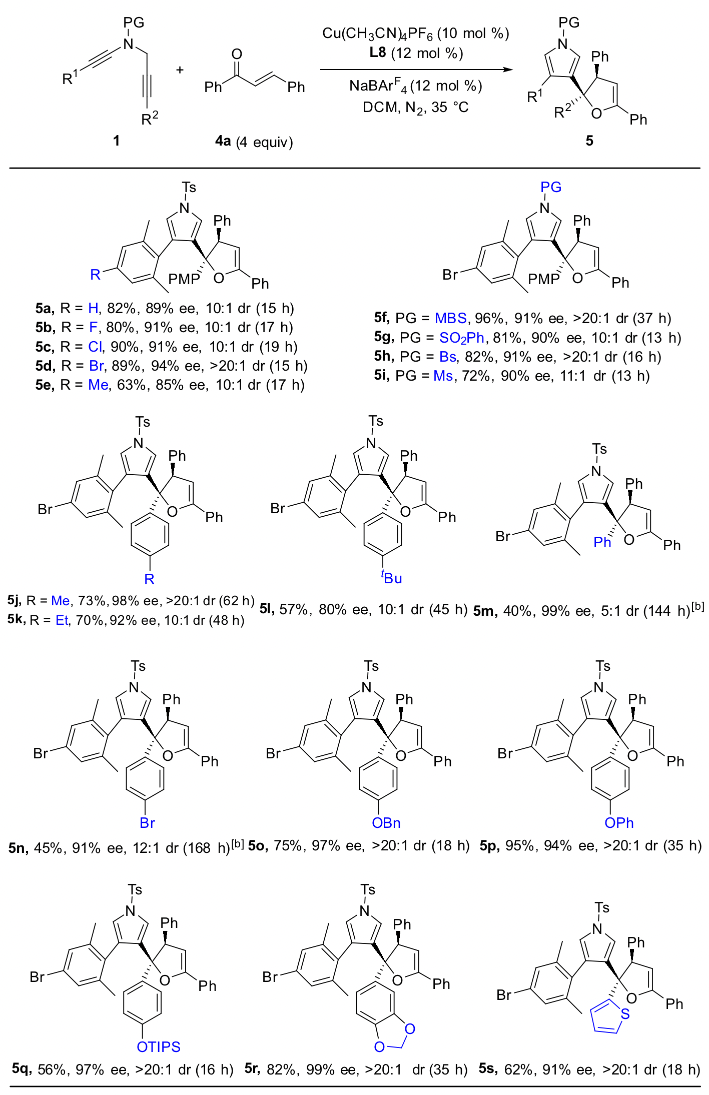
作者通过条件筛选发现,大位阻的双噁唑啉配体对提高产物的对映选择性和非对映选择性至关重要,在最优反应条件下,1,5-二炔与芳基芳基酮反应能以中等到优秀的收率和对映选择性实现具有高挑战性的手性四取代环氧化合物的不对称合成,特别是对于非对称的芳基芳基酮也能以优秀的收率、对映和非对映选择性得到含有连续两个手性季碳中心的四芳基取代环氧化合物(图 2,图3)。
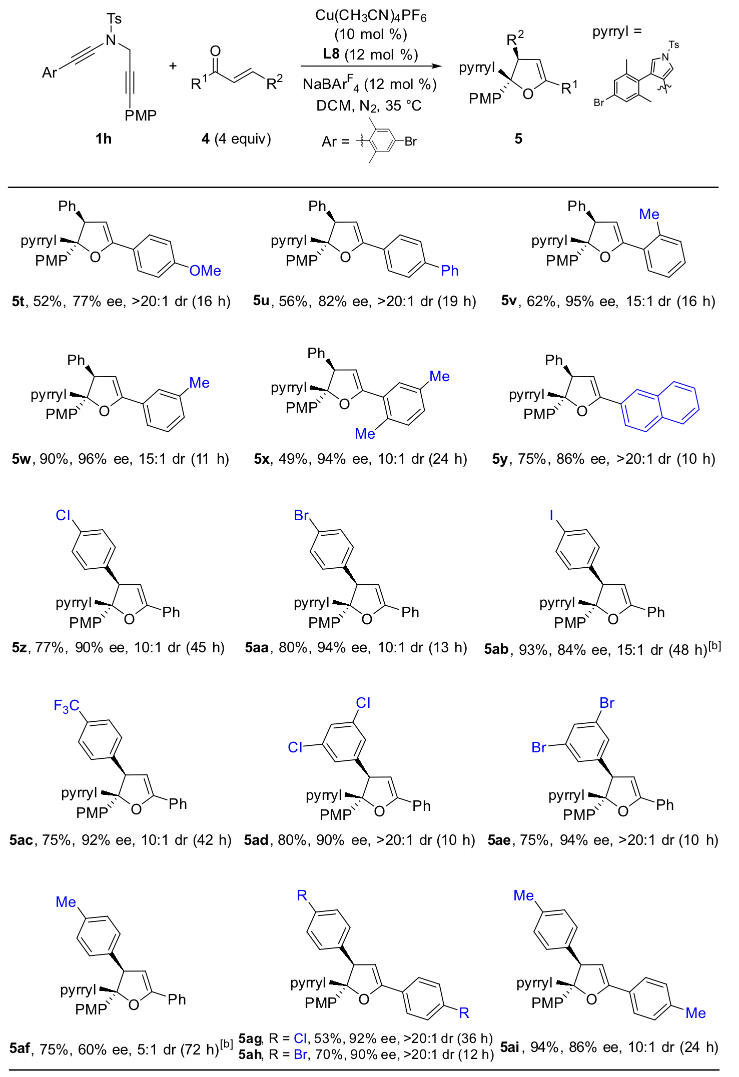

总结
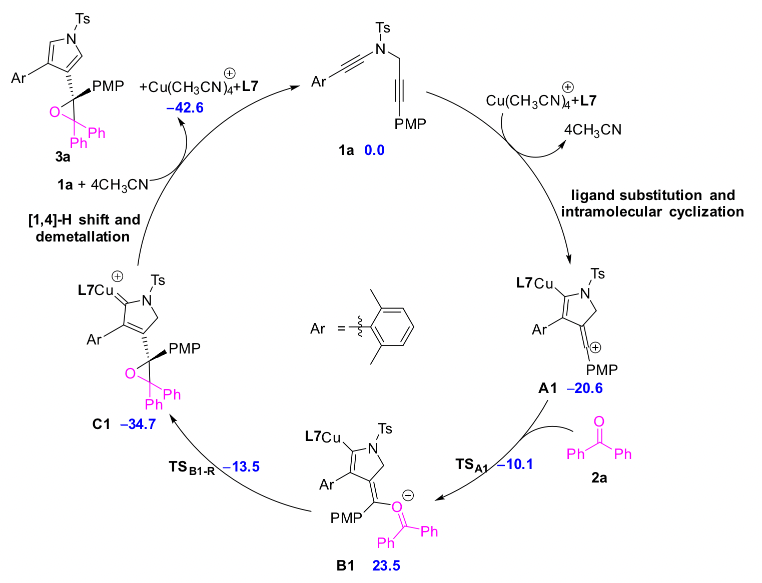
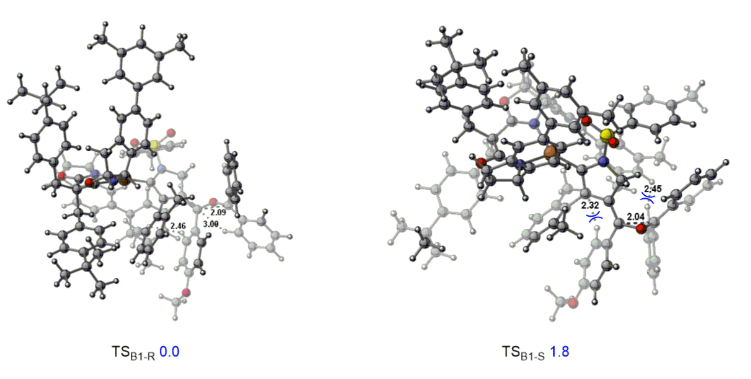
厦门大学叶龙武教授课题组在前期有关铜催化1,5-二炔不对称环化反应的基础上,通过远程立体化学控制策略避免了金属的解离,从而顺利实现了铜催化1,5-二炔与羰基化合物经由羰基叶立德中间体的不对称环化反应,多样性和原子经济性的得到了手性四取代环氧乙烷和二氢呋喃类化合物,另一方面,该反应的实现也为基于烯基阳离子的不对称转化提供了新思路。最后,作者通过密度泛函理论(DFT)计算,进一步明析了该类反应的机理和不对称控制模式。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn