

Halichondrins作为一类有效的抗肿瘤天然产物,自被发现起就引起了学术界和制药行业的极大关注。通过Kishi课题组与卫材药业公司的开发,Halichondrins B的结构类似物Eribulin已成功得到了商业化应用,其临床使用的甲磺酸盐以商品名Halaven销售,被用于治疗转移性乳腺癌和脂肪肉瘤(图1)。
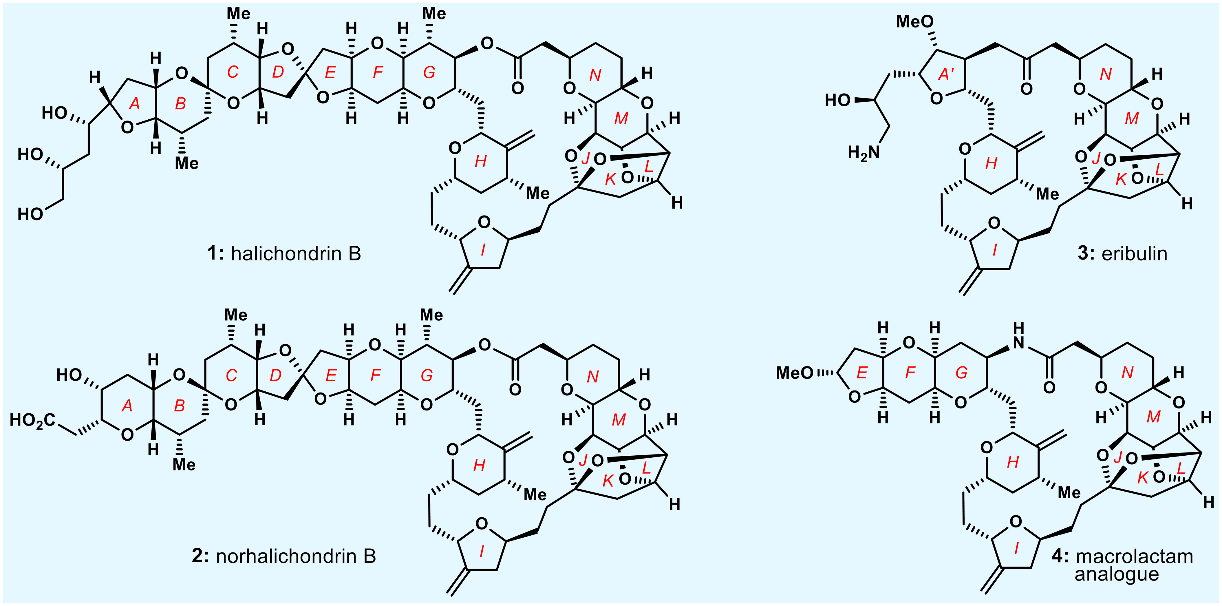
图1. Halichondrin B (1), Norhalichondrin B (2), Eribulin (3)以及大环内酰胺类似物4的分子结构(图片来源:PNAS)
图2A为卫材药业开发的用于Eribulin和Halichondrins B类似物合成的两种策略。相关药理学和构效关系研究表明,Eribulin的片段A'和Halichondrins B的片段ABCDEFG是这类分子具有活性的关键片段,其结构修饰可用于改善分子的生物学和药理学特性。因此,从药物化学的角度来看,片段A'的后期引入可以提高相关类似物的合成效率。基于此,作者尝试开发后期引入A'片段的通用合成方法,用于Eribulin的全碳大环结构和其他Halichondrins B的大环内酯和大环内酰胺类似物的合成,为该领域下一代抗癌先导化合物的发现和优化提供可能(图2B)。
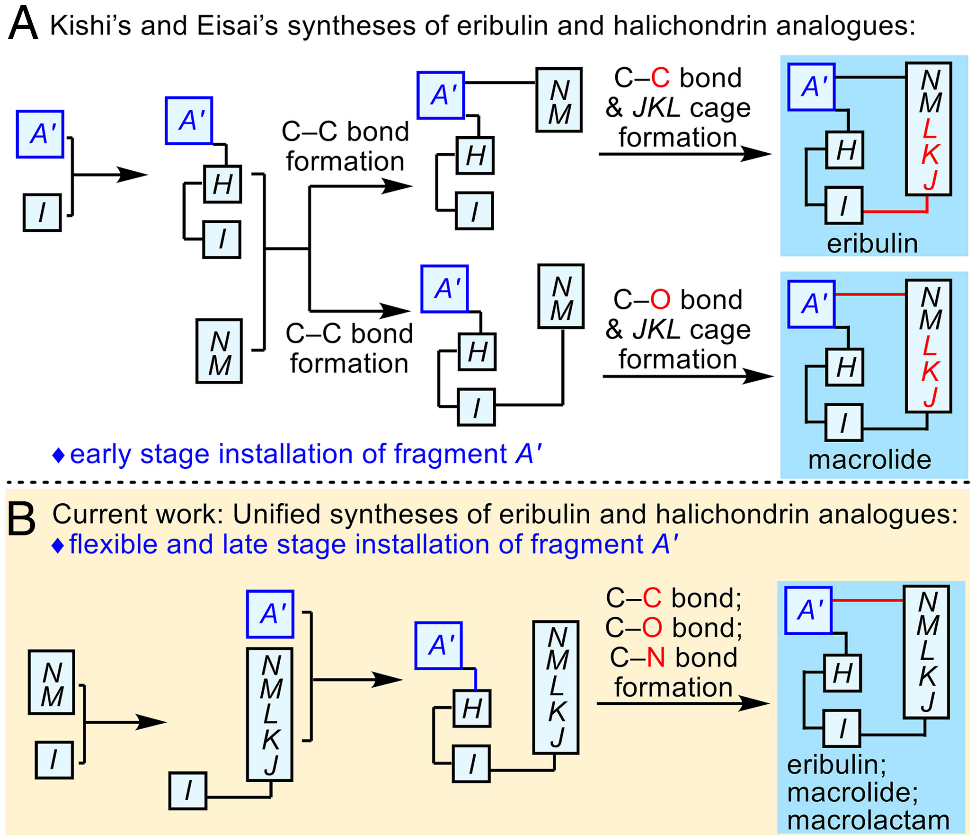
图2. Eribulin及其类似物的合成模式(图片来源:PNAS)
作者首先进行了逆合成分析(图3):对于第一步开链,中间体6可通过必要的官能团转化及关环反应得到3和5。6通过Nozaki-Hiyama-Kishi偶联和环醚化断开其环H可逆推至片段A' (7a或7b)和片段IJKLMN (8)。
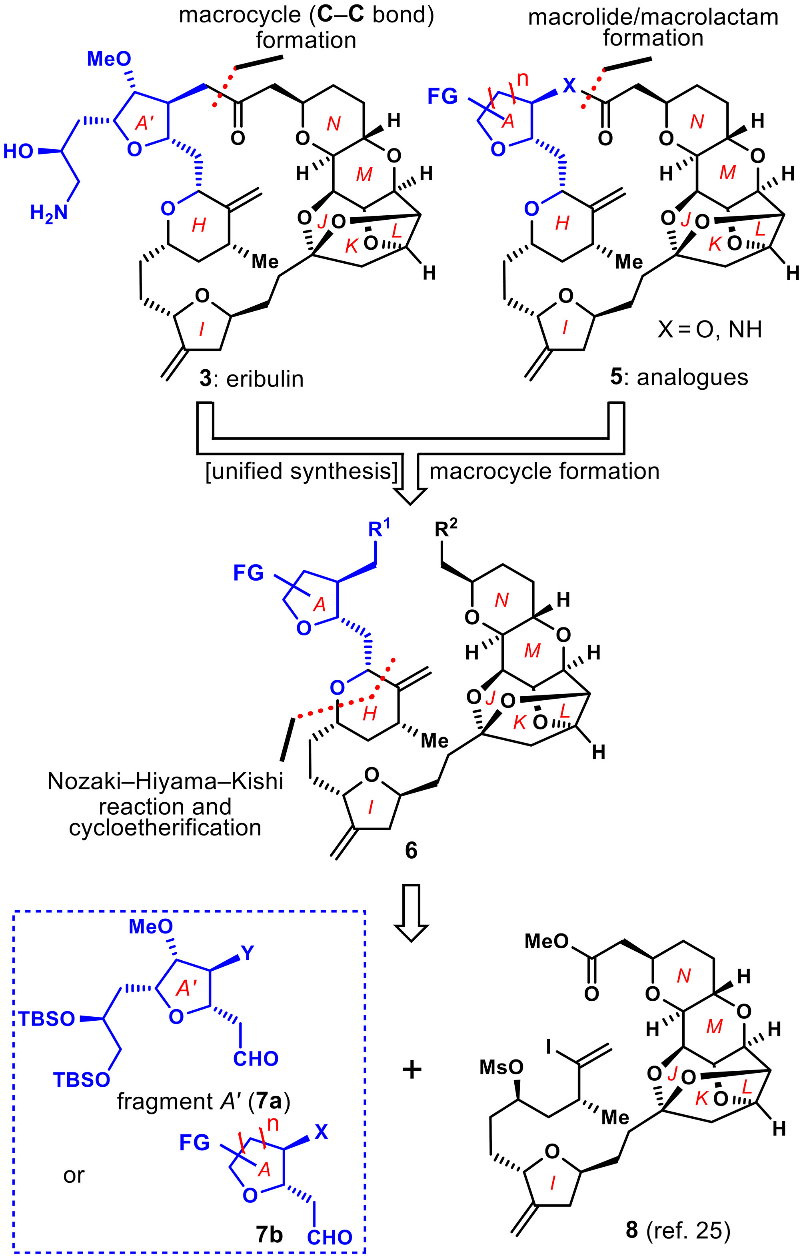
图3. Eribulin (3)及类似物 (5)的逆合成分析(图片来源:PNAS)
1)片段MN (17) 和片段IJKLMN (8)的优化合成。
关于片段MN (17) 和片段IJKLMN (8)的合成,作者主要是在此前报道的方法基础上进行改进(图4)。首先利用此前的策略,使用砌块9和10快速合成化合物11,作为此片段合成的开始。采用镍催化的还原环化代替此前报道的锡介导自由基环化,能以更高收率得到双环骨架化合物13。13在C8处的优异非对映选择性(>15:1)表明该镍催化的还原环化是通过优势的椅式过渡态12a进行。用 Dess-Martin试剂氧化烯丙醇化合物13 生成烯酮14,使用O3氧化其双键再与NaBH4反应能立体选择性合成二醇15。15经脱保护和对二醇结构的保护,一锅法得到化合物16。最后使用Dess-Martin试剂氧化伯醇化合物16,得到目标片段 MN (17)。此8步反应的策略以14%的总收率由原料10合成出片段MN (17),相比于此前作者报道的9步反应(总收率6.3%)有显著进步。
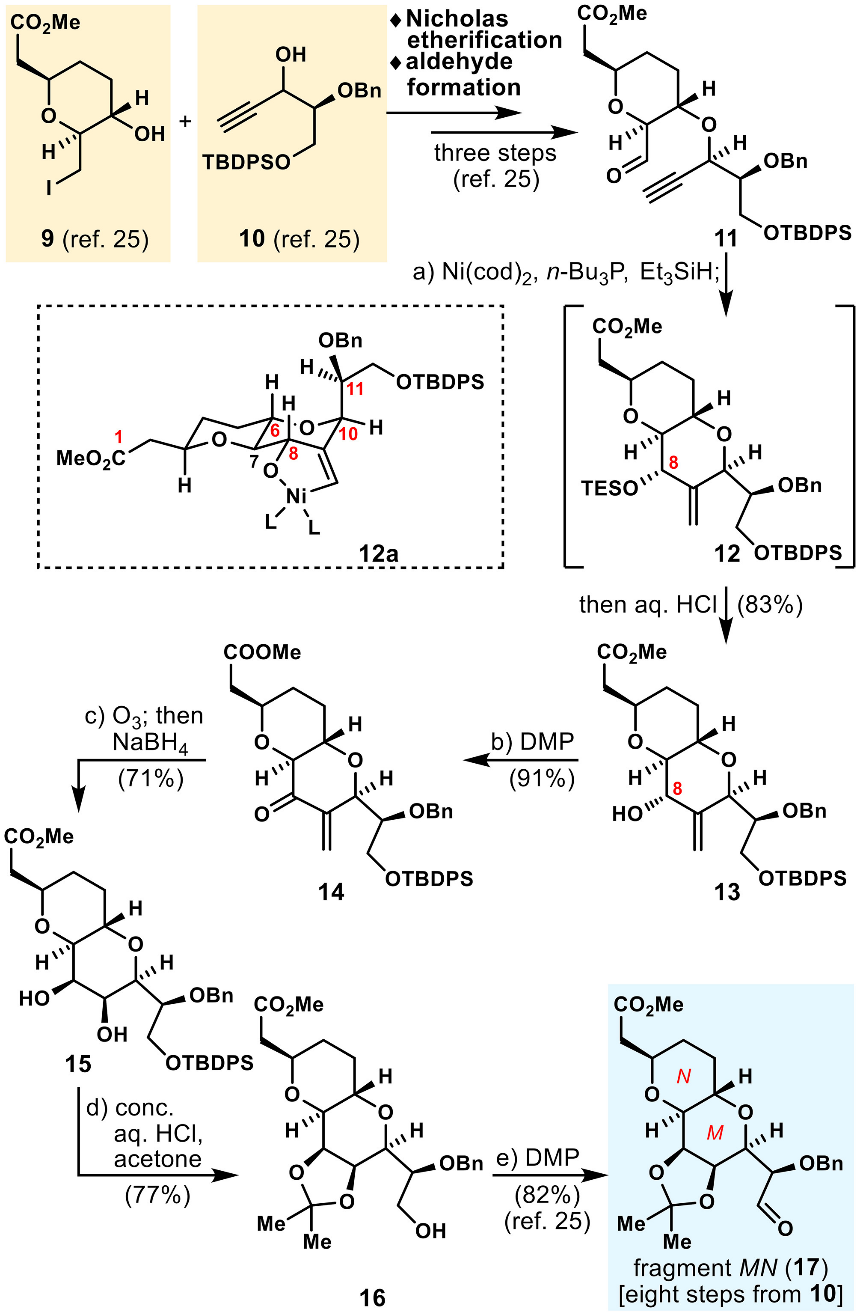
图4. 片段MN (17)的优化合成(图片来源:PNAS)
随后,作者继续优化二醇化合物19的苄基脱保护反应条件(图5)。经过条件筛选发现,化合物19 (C12位非对映异构体比例(dr)为2:1)、DDQ和BHT 的混合物在紫外光 (λ = 390 nm) 照射下,使用连续流动体系,能实现苄基保护基的高效脱除,以70%的产率生成相应的三醇中间体20 (C12位差向异构体的混合物)。最后在p-TsOH·H2O的作用下得到笼状化合物 21。未反应的C12-epi-20可用NaOMe处理,通过差向异构化分离回收得到20 (2.2:1 dr)。最后, 使用此前报道的方法(MsCl, Et3N)可成功由21制备所需的磺酸酯化合物8 (片段 IJKLMN)。
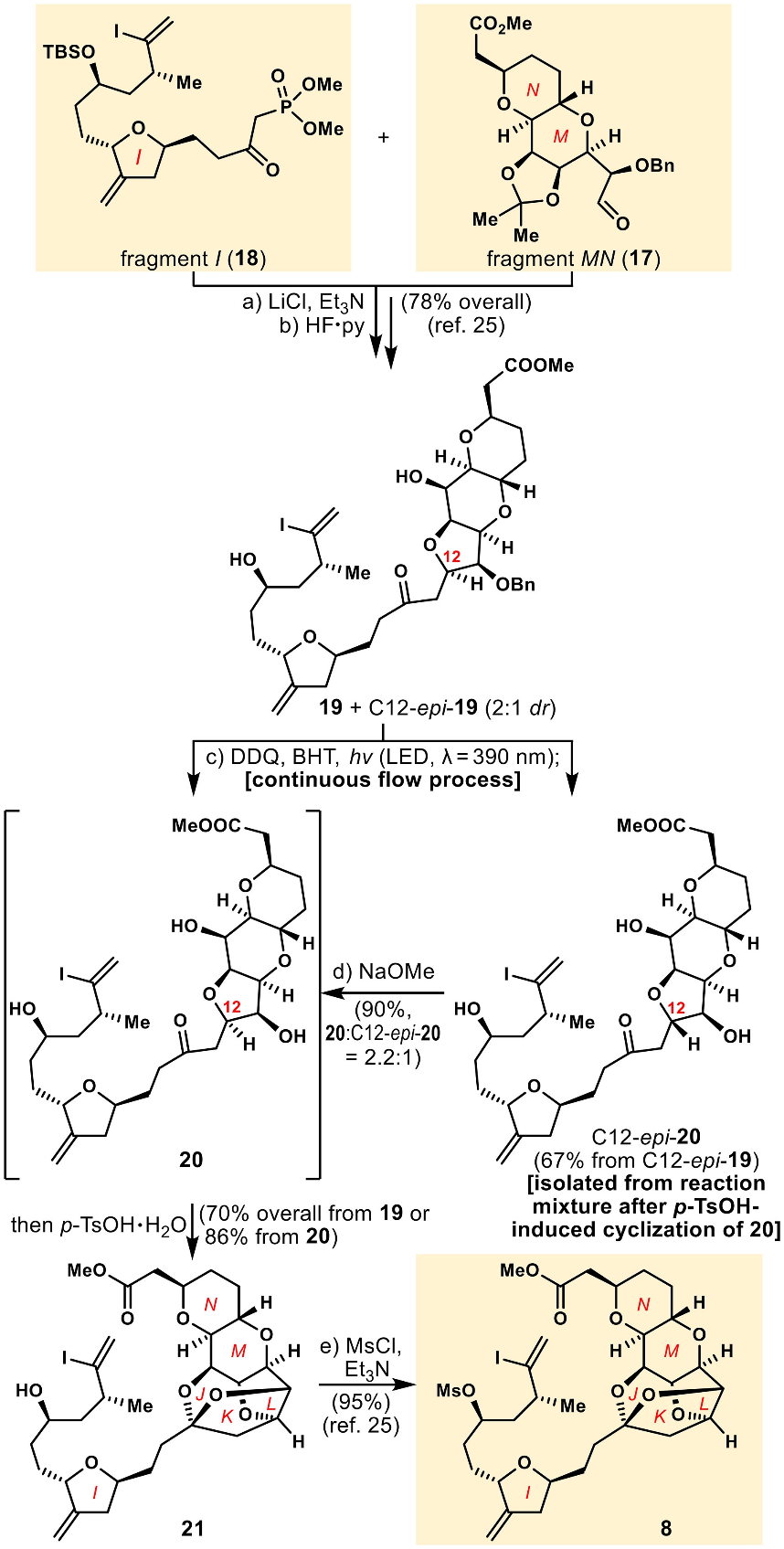
图5. 片段IJKLMN (8)的优化合成(图片来源:PNAS)
2)片段A' (33)的合成路线及Eribulin (3)的合成研究。
作者研究了Eribulin的另一主要砌块片段A' (33)的合成路线(图6)。该片段的合成由易获得的结构单元α-羟基酯22和羟基炔23出发。化合物22和23 在Co2(CO8)催化下发生Nicholas反应,再依次用BF3·Et2O和(NH4)2Ce(NO3)6处理得到非对映异构体醚24a(产率31%)和24b(产率46%)。24b在Lindlar催化剂催化下加氢再与DIBAL-H反应得到环化前体25。25用盐酸羟胺处理,再被NaOCl氧化得到腈氧化物,其自发的1, 3-偶极环加成反应生成异噁唑啉26。随后在Mo(CO)6作用下发生还原N-O键断裂,得到化合物27,进一步使用Me4NBH(OAc)3进行立体选择性还原得到二醇28。随后依次进行伯醇的选择性苯硫基化、仲醇的甲基化和硫醚的氧化最终得到砜30。进一步的保护基更换和Sharpless不对称二羟基化可以70%的产率得到化合物32,其最终发生羟基选择性氧化得到化合物33,完成片段A'的构建。
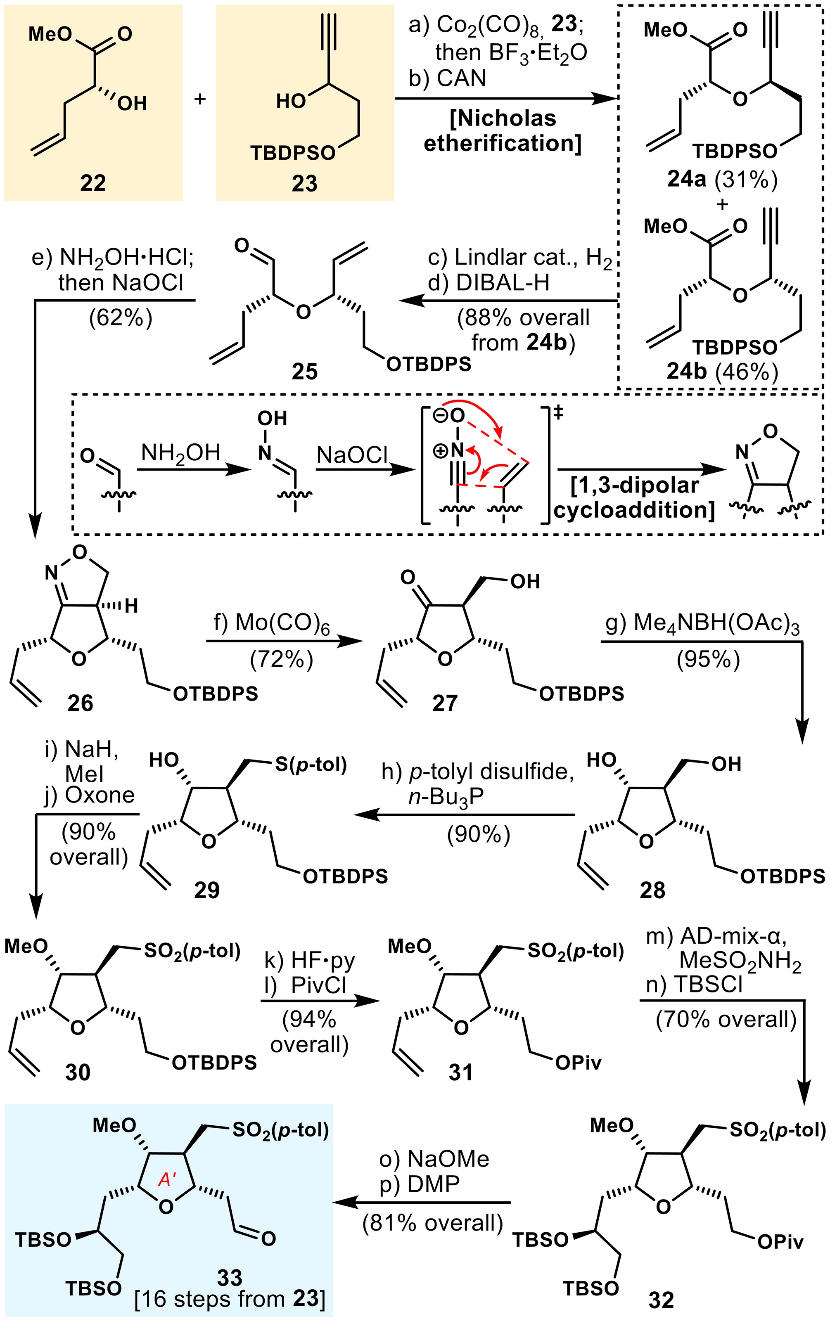
图6. Eribulin 片段A′ (33) 的首次合成(图片来源:PNAS)
随着片段A' (33)和 IJKLMN (8)的成功合成,作者又研究了它们之间的偶联反应及进一步用于Eribulin (3)的合成(图7)。片段33和8之间可通过NiCl2/CrCl2作用下发生Nozaki-Hiyama-Kishi反应以47%的收率得到化合物34,随后在DBU作用下发生环醚化,得到化合物35。然而,作者尝试了各种碱性条件下诱导化合物35的大环化,如LDA、NaHMDS、KHMDS和t-BuOK,均未能得到目标产物Eribulin的前体化合物36。
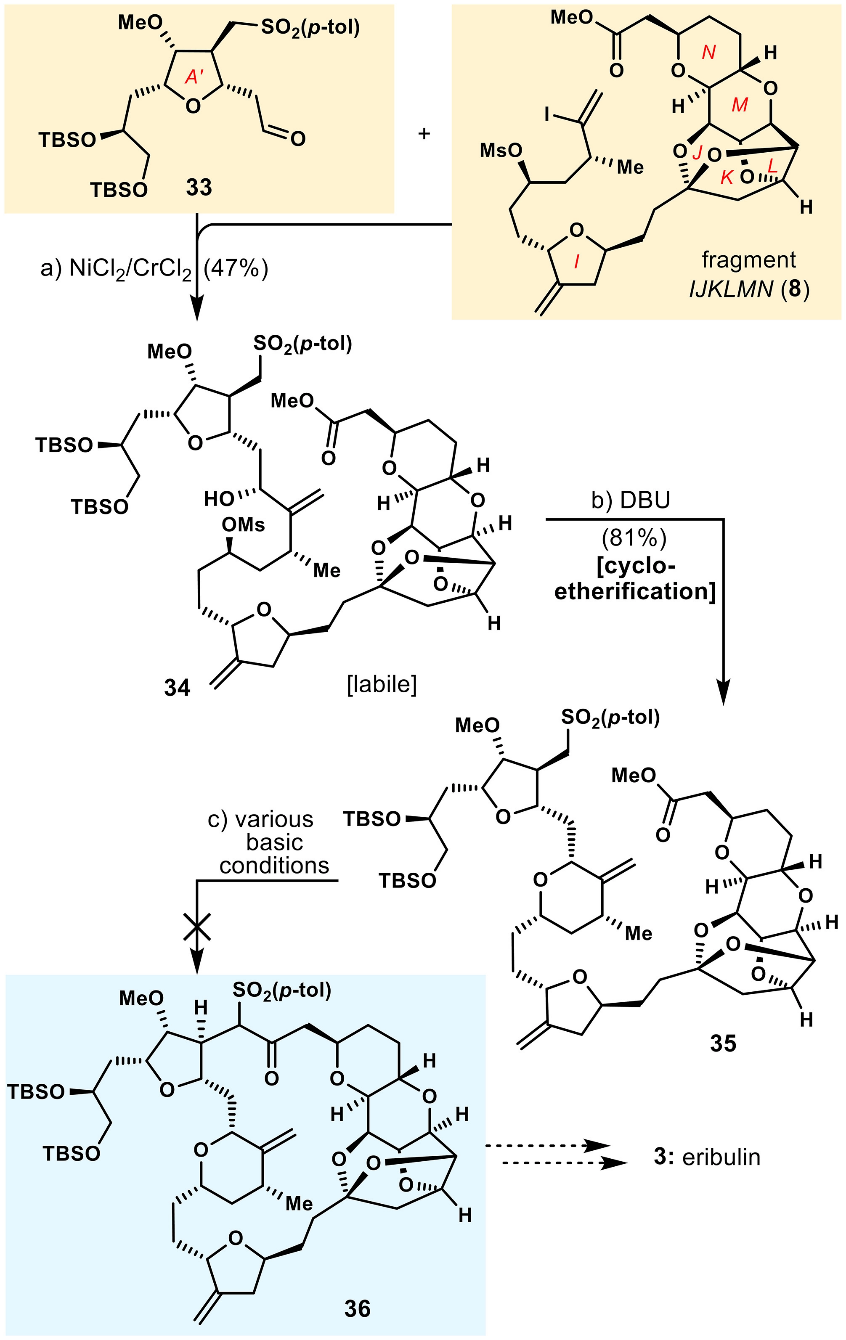
图7. Eribulin (3)的合成尝试(图片来源:PNAS)
3)从砌块分子28和片段IJKLMN出发实现Eribulin (3)的合成。
由于未能通过片段A' (33)和IJKLMN (8)完成Eribulin前体化合物的合成,作者重新设计了一种片段A的改进型化合物A'' (38),希望通过碘醛底物44的合成,再进一步诱导分子内 C-C 键形成,完成Eribulin大环结构的构建(图8)。首先对化合物28依次进行伯醇选择性保护、仲醇甲基化、非对映选择性二羟基化和二醇结构的保护,以四步45%的总收率获得化合物37。使用TBAF脱保护再用DMP氧化伯醇,得到目标化合物A'' (38)。将片段A'' (38)与片段IJKLMN (8)进行Nozaki-Hiyama-Kishi偶联,再用DBU处理进行环醚化得到合成Eribulin的重要前体化合物40,两步总产率56%。
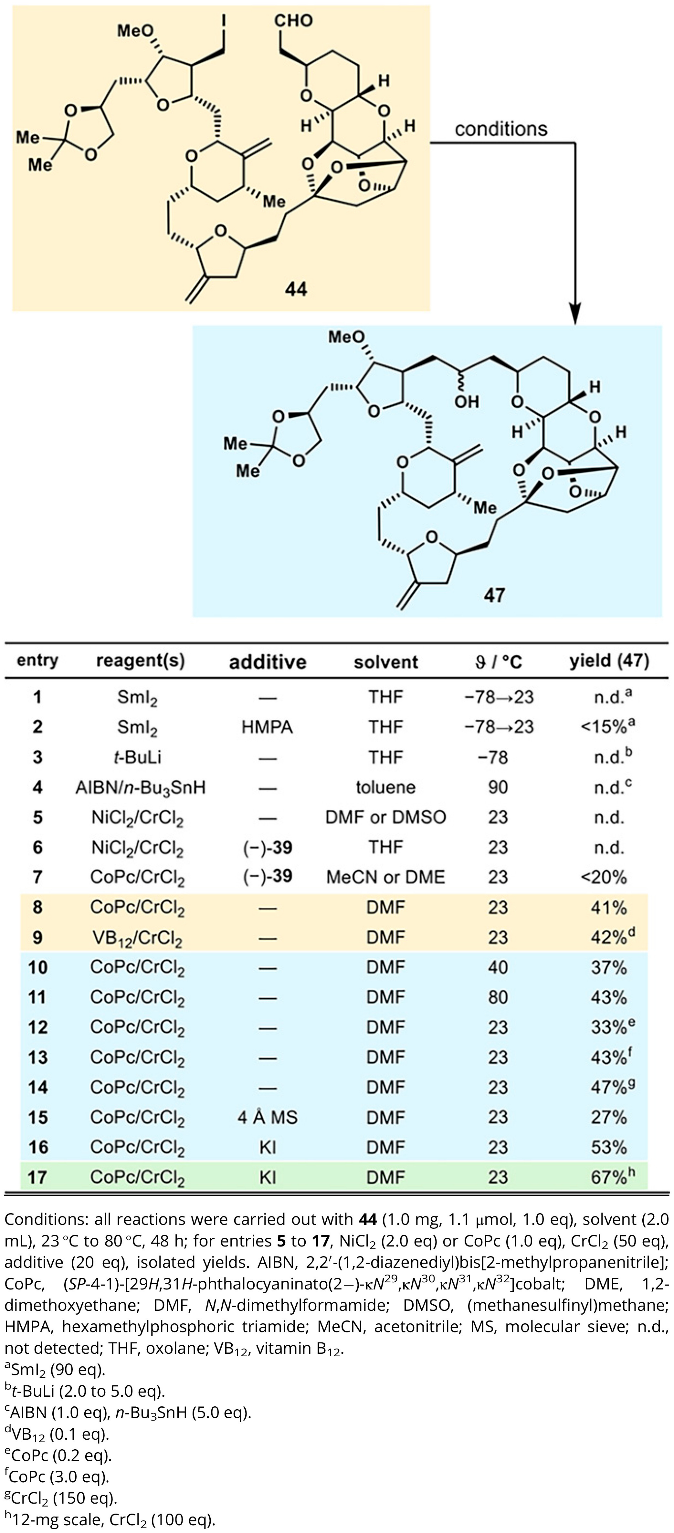
图8. 从砌块分子28和片段IJKLMN (8)出发实现Eribulin (3)的合成。(图片来源:PNAS)
构建Eribulin全碳大环的最后一步C-C键形成是极具挑战性的工作。此前,Kishi等人了采用分子内Nozaki-Hiyama-Kishi反应(碘代烯烃/炔烃-醛偶联)、闭环复分解和Horner-Wadsworth-Emmons烯基化反应用于构筑该大环。K. C. Nicolaou教授课题组首先将化合物41转化为各种潜在的重要前体(42、44 和45),用于后续转化。然而,使用 SmI2诱导化合物42的醛-酯大环化无法形成C-C键。随后作者将碘-醛化合物44转化为TBS保护的氰基醇化合物45,尝试以此为前体在碱性条件下发生烷基碘的取代反应,从而构筑C-C键。但在筛选了LDA、LiHMDS和DBU等强碱后均未能生成大环46。因此作者尝试直接使用碘-醛化合物44作为前体进行C-C偶联,开发全新的使用烷基卤代物直接与醛偶联的新方法。通过仔细优化反应条件,最终发现使用CoPc/CrCl2试剂组合,KI为添加剂能以最优67%的产率获得关环产物47(图9)。
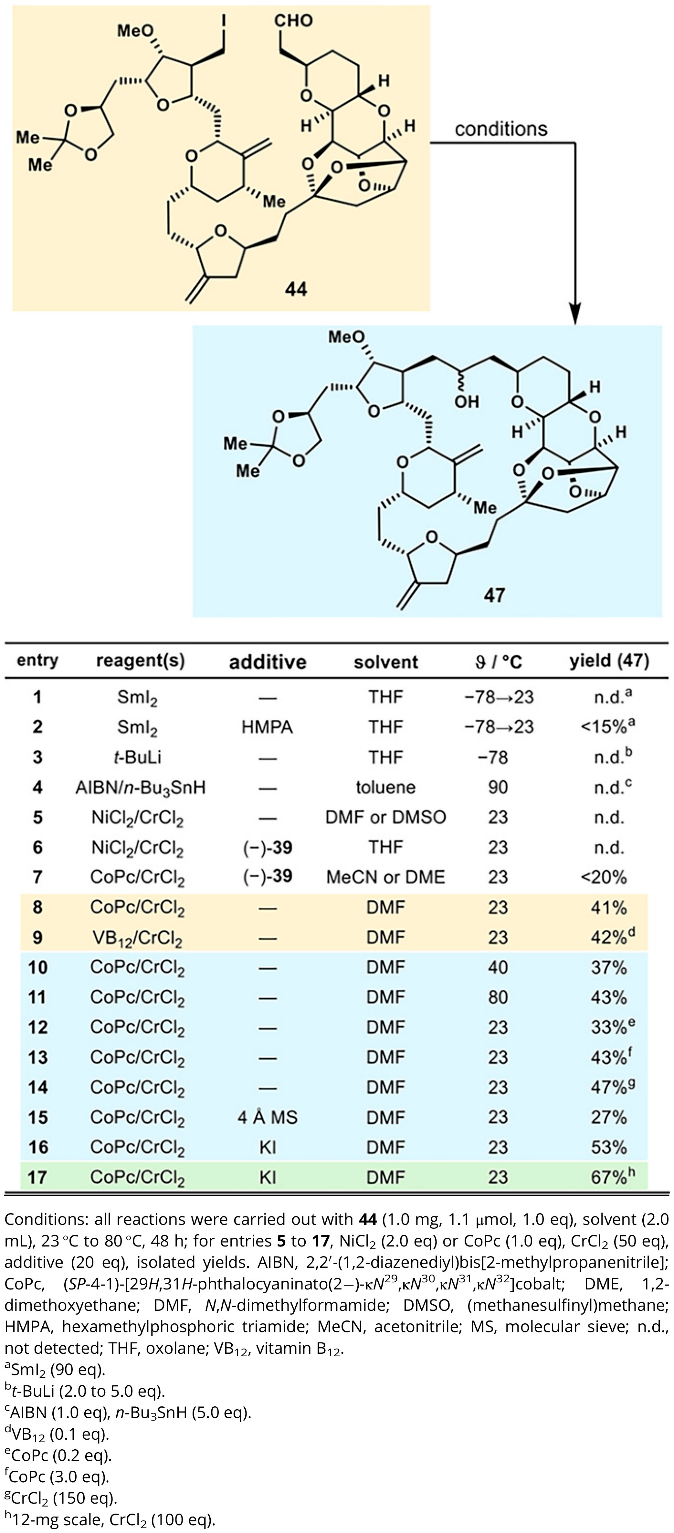
图9. 化合物44的大环化反应条件筛选(图片来源:PNAS)
完成最具挑战性的大环构建之后,只需要三步反应即可完成Eribulin的全合成(图8)。首先使用Dess-Martin试剂氧化化合物47上的醇羟基,再对二醇结构进行脱保护得到化合物48。最后二醇48通过选择性磺酰化再进行胺化能以67%的收率成功得到Eribulin。
4)Halichondrin B 类似物大环内酰胺4的合成.
为扩大该合成策略的应用,作者进一步将其用于Halichondrin B类似物大环内酰胺化合物4的合成(图10)。首先,三环酮化合物49被立体选择性还原得到非对映异构体50a和50b,其可通过色谱进行分离。醇50b依次进行磺酰化和亲核取代叠氮化得到构型反转的叠氮化合物51。进一步还原为胺并用Boc基团保护得到化合物52,随后脱去醇上的硅保护基并用DMP氧化得到醛53(片段EFG)。对片段EFG(53)和片段IJKLMN(8)进行镍催化Nozaki-Hiyama-Kishi偶联,得到产物54,产率72%。54在DBU处理条件下得到优势构型环醚产物55,再用TBSOTf进行保护基替换得到化合物56。最后发生脱保护和水解游离出羧基和氨基,并在EDCl和HOAt作用下以73%的收率获得目标大环内酰胺产物4。
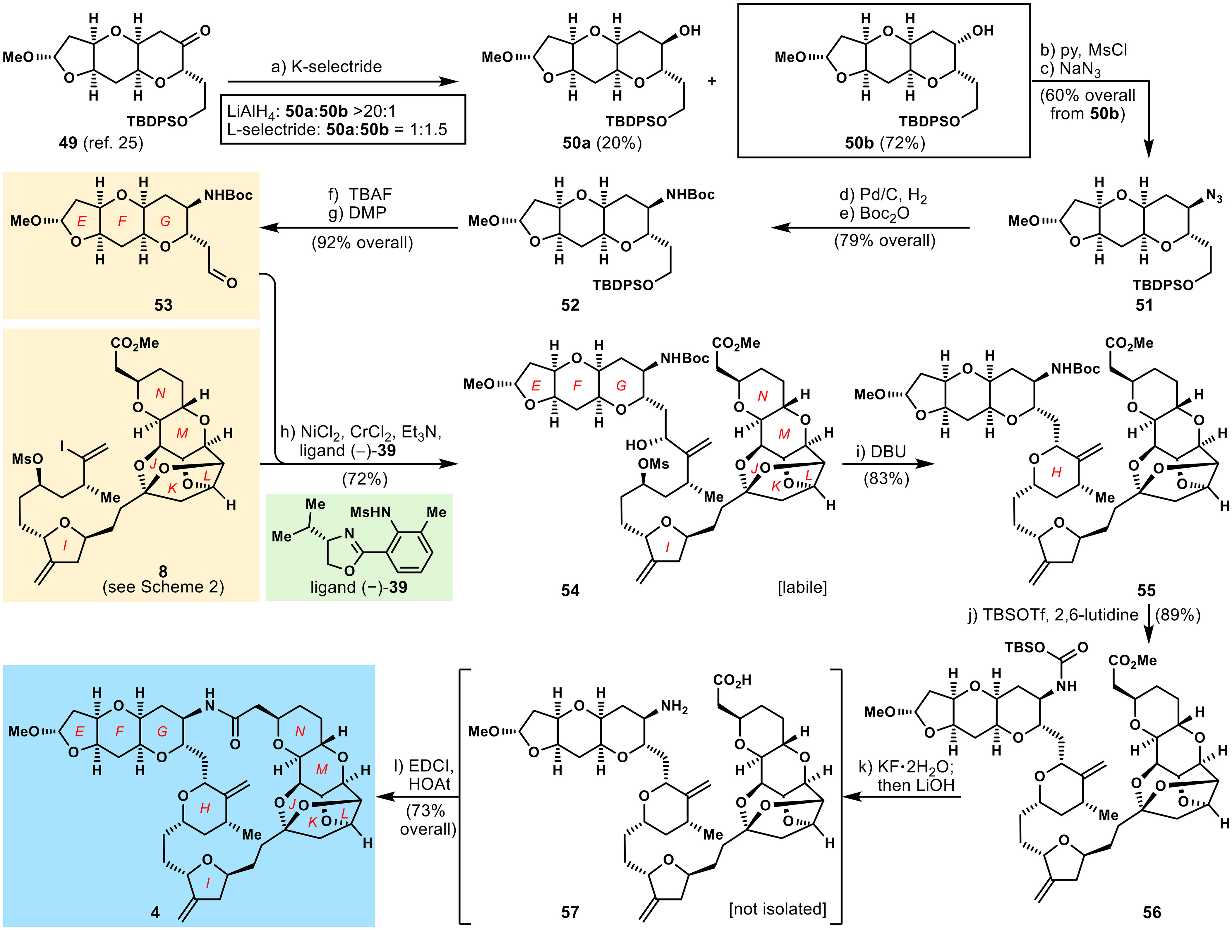
图式10. Halichondrin B 类似物大环内酰胺4的合成(图片来源:PNAS)
总结 K. C. Nicolaou教授课题组开发了一种通用合成策略,用于Eribulin(3)和Halichondrin B类似物大环内酰胺化合物4的全合成。相对于此前的所报道的方法,作者逆向构建环醚结构单元(即先形成C-O 键,再形成 C-C 键),为Halichondrin类化合物大环醚结构片段的合成提供新思路。同时作者发展了全新的烷基碘化物与醛C-C键偶联构建大环的策略,具有重要的应用潜力。另外,片段A'或A''的后期引入策略可实现Eribulin和Halichondrin类分子的灵活合成,将更有利于这类化合物药理学性质和构效关系的研究。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn